Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà dei materiali e dei metalli
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G01 - Proprietà materiali - Pag. ATS-G01.02
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Si considerano alcune caratteristiche degli elementi allo stato fondamentale e alcune delle reazioni analiticamente più significative, che riguardano gli ioni più stabili e importanti che questi metalli formano.
Per ogni metallo si terrà conto del potenziale normale di riduzione di Nernst (E0) che, rispetto a quello dell'idrogeno, potrà essere positivo o negativo.
Questo dato è utile per conoscere a priori se un metallo può o meno essere attaccato, ovvero ossidato, dai normali acidi minerali, almeno in via teorica. Infatti un potenziale normale negativo significa che l'equilibrio:
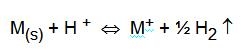
è spostato verso destra, e quindi che il metallo M è effettivamente ossidato dagli ioni H+ provenienti dall'acido. E', ad esempio, il caso dello zinco:
![]()
che si scioglie in acido cloridrico.
Per altri metalli più nobili, come ad esempio l'argento, che ha un:
![]()
non basta l'azione dell'acido cloridrico, ma occorre usare un acido che sia anche ossidante, come l'acido nitrico.
• Tutti i metalli, con l’eccezione del mercurio, sono allo stato solido alla temperatura ambiente.
• Allo stato solido, gli atomi sono disposti in modo regolare. Essi formano una struttura ordinata e ripetitiva, chiamata reticolo cristallino.
• In tale reticolo gli atomi sono disposti ai nodi. Gli elettroni più interni restano legati ai nuclei, quelli più esterni possono muoversi facilmente.
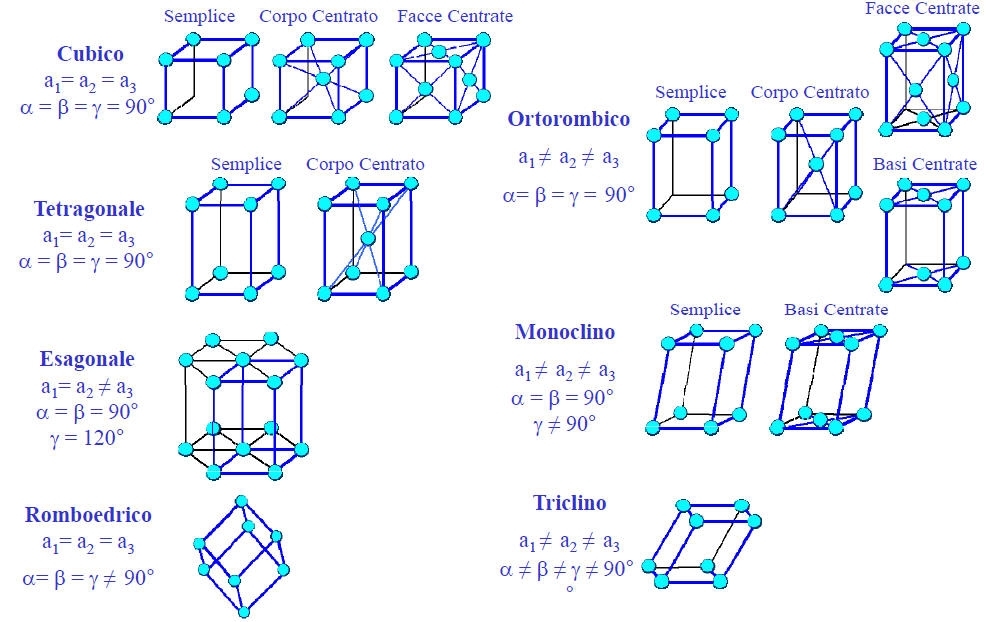
• Considerazioni puramente geometriche permettono di affermare che esistono solo 14 modi diversi di costruire dei reticoli nello spazio (reticoli di Bravais) -
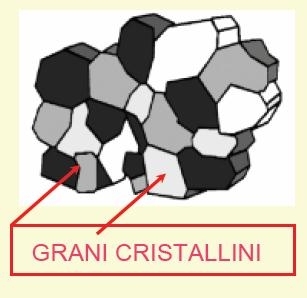
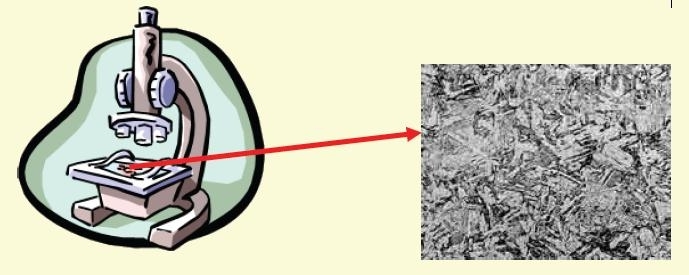
Durante la solidificazione di un metallo liquido si formano progressivamente in tutta la massa i "grani cristallini"affiancati .I grani sono visibili con un microscopio ottico ( x 200 ) sulla superficie di un provino levigata ed attaccata con acido.
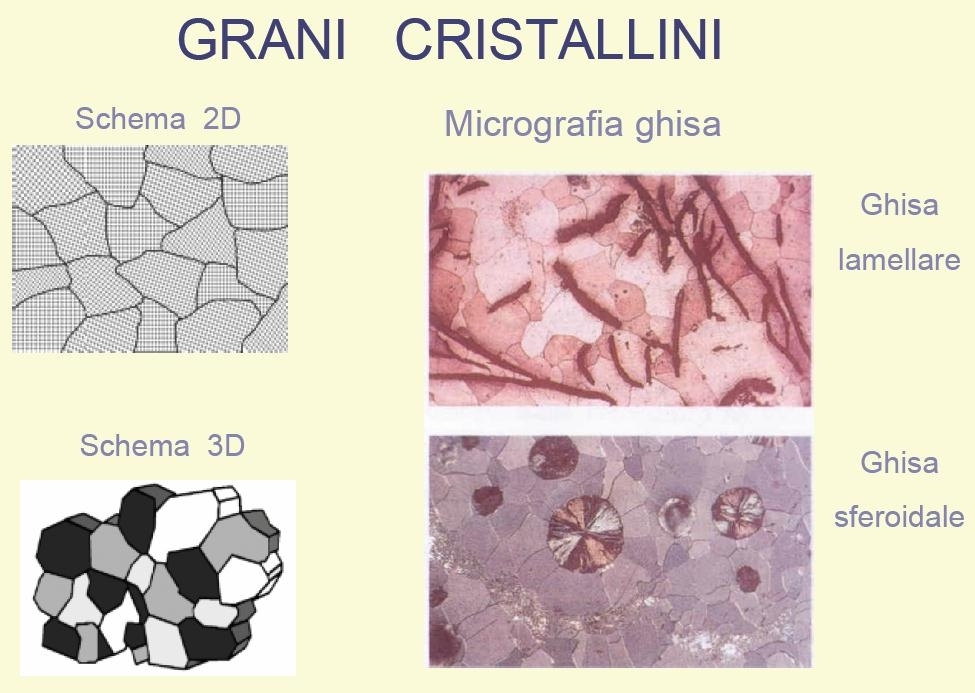
Nello stesso metallo gli atomi si dispongono sempre secondo lo stesso reticolo.
CELLA ELEMENTARE: In un metallo puro, allo stato solido, gli atomi si dispongono secondo una geometria ordinata e regolare, chiamata reticolo cristallino, che si sviluppa in tutta la massa. Il reticolo cristallino è composto da un insieme di innumerevoli CELLE ELEMENTARI uguali che si ripetono in tutte le direzioni .
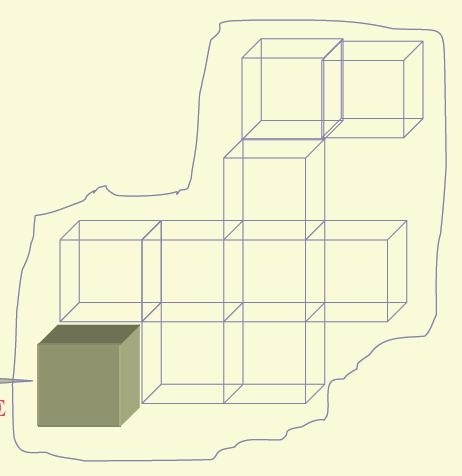
Cella elementare
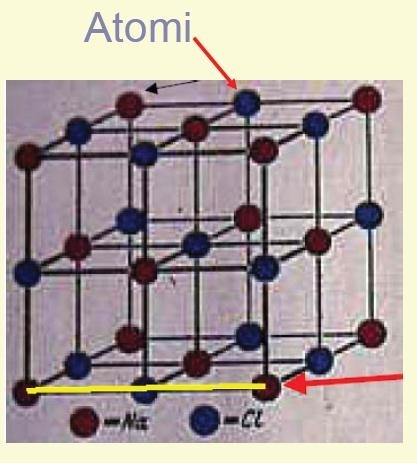
Il reticolo cristallino è una struttura virtuale ottenuta unendo le particelle ( atomi, gli ioni o le molecole) che formano il solido ; in esso si distinguono :
Nodi : punto ove si trova l’atomo.
Filari : insieme di atomi allineati.
Piani reticolari : insieme di nodi che sono su un piano.
Celle elementari : unità che si ripete indefinitamente nella massa.
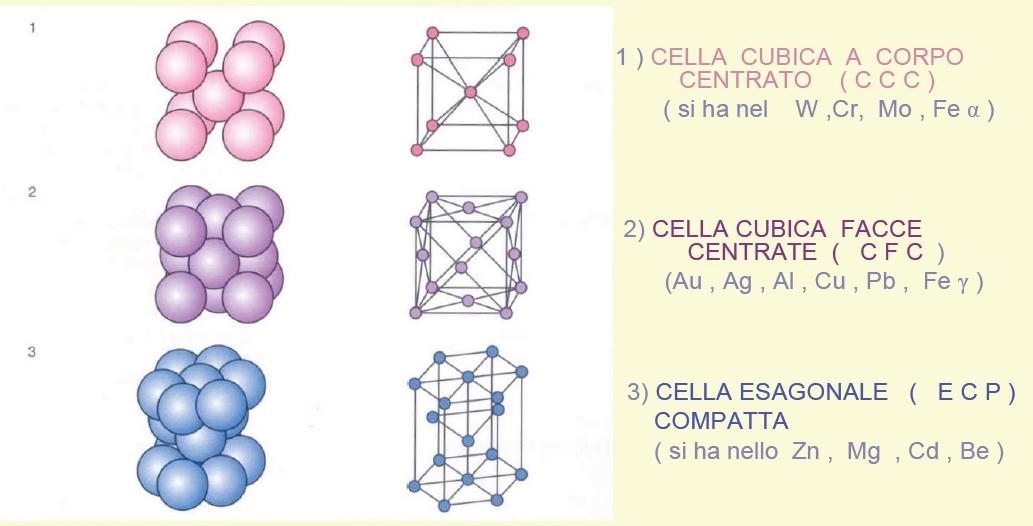
La sovrapposizione dei piani cristallini a massima compattezza permette di formare reticoli cristallini ad elevata densità:
Ha la forma di un prisma retto a base esagonale ed è composta da 17 atomi; di cui 12 si trovano ai vertici del prisma, 2 ai centri delle basi e 3 all’interno del prisma .


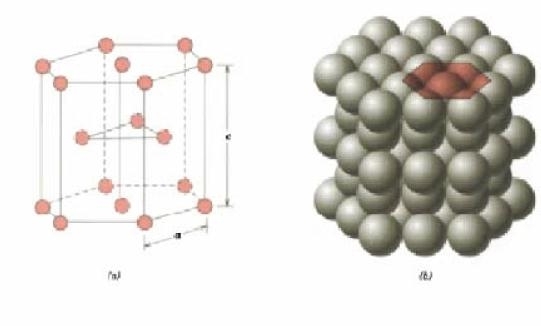
E’la struttura tipica dei materiali fragili quali Zinco (Zn), Magnesio (Mg).
Ha la forma di un cubo a base esagonale ed è composta da 14 atomi; di cui 8 si trovano ai vertici del cubo e 6 ai centri delle facce del cubo.


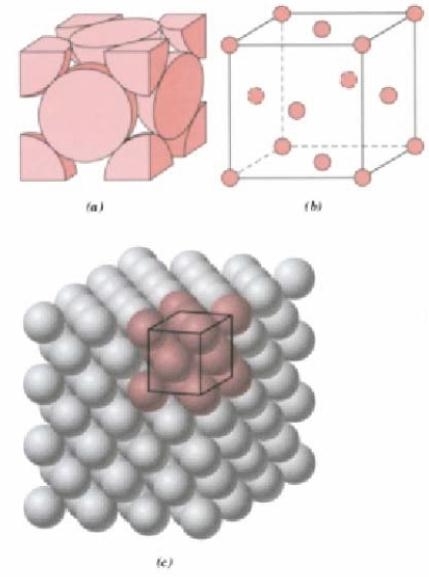
E’la struttura tipica dei materiali più duttili quali Rame (Cu) Alluminio (Al) , Oro (Au) , Argento (Ag) ; Ferro-γ.
La sovrapposizione di piani cristallini a compattezza ridotta permette formare reticoli cristallini con densità inferiore:
Ha la forma di un cubo ed è composta da 9 atomi; di cui 8 stanno ai vertici del cubo ed 1 al centro del cubo.


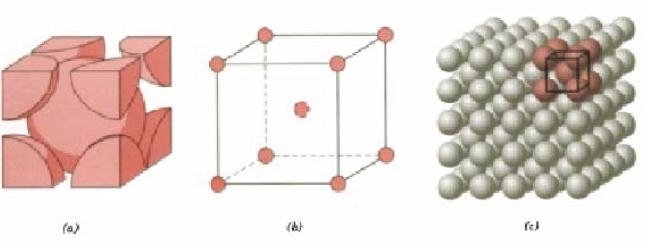
E’la struttura tipica dei materiali più duri quali Tungsteno ( W), Ferro-αMolibdeno (Mo).
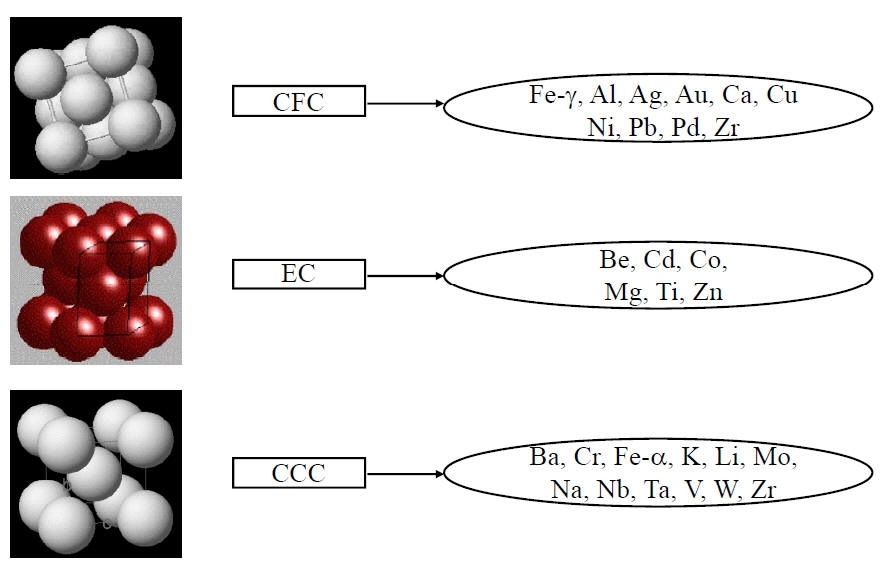
Principali metalli nella suddivisione dei reticoli cristallini:
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-013 - Lucidi del corso di "Metallurgia" sono disponibili in formato pdf all’indirizzo: http://www.metallurgia.unicas.it
Bib-TS-092 - L. Mugnani - Manuale pratico di fonderia - Milano, 1928
Bib-TS-093 - Dispense di Chimica - A.A. 1992/1993 - Facoltà di Ingegneria Edile / Architettura - Pavia