Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Metallurgia dei metalli e delle leghe
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-H02 - Metallurgia - Pag. ATS-H02.09
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
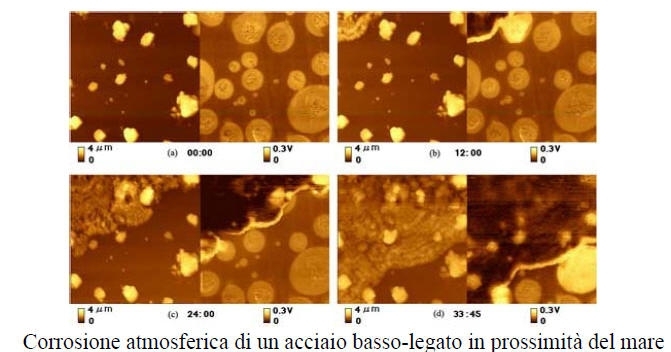
Corrosione.
E’ il processo antitetico a quello della metallurgia estrattiva in quanto il metallo tende a riassumere una forma ossidata non dissimile da quella originaria del minerale. Tale processo è caratterizzato da una variazione negativa di energia libera (ΔG<0), quindi avviene spontaneamente.
Gli ambienti più comuni per i fenomeni di corrosione sono rappresentati da soluzioni acquose contenenti elettroliti, da so u o co e e e e o , acide (H2SO4, HCl…) a basiche (NaOH, acqua di mare…), dall’atmosfera (per formazione di condensa), dal terreno, da gas ad alta temperatura (corrosione a secco).

Lo schema elementare per introdurre il fenomeno della corrosione è quello di metalli diversi a contatto fra loro e con una soluzione acquosa.
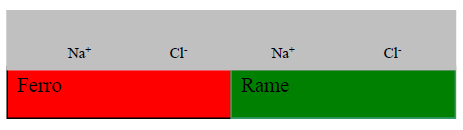
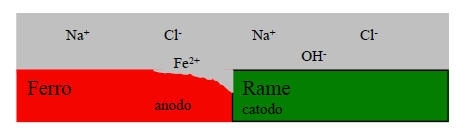
Il metallo meno nobile, in questo caso il ferro, si ossida secondo la reazione anodica:
Fe = Fe++ + 2e-
Sulla superficie del metallo più nobile (in questo caso il rame) si verifica una delle due reazioni catodiche, secondo la presenza o meno di ossigeno:
Reazione catodica con ossigeno:
1/2 O2 + H2O + 2e- = 2OH
Reazione catodica senza ossigeno:
2 H2O + 2e- = H2 + 2OH-
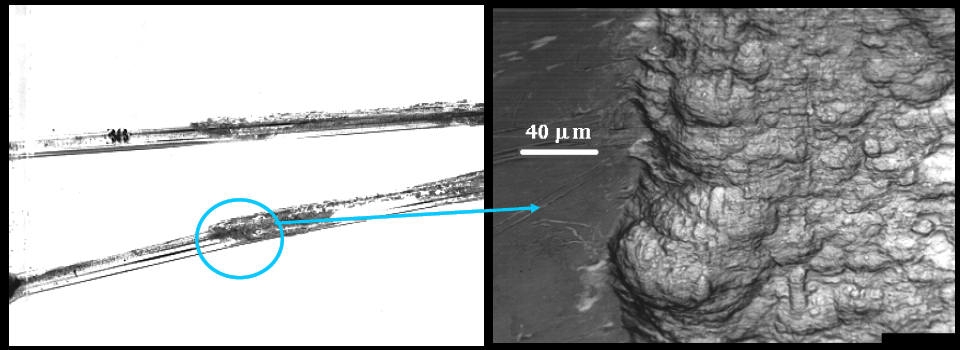
La velocità di corrosione è un parametro che misura il passaggio di elettroni; nel caso di corrosione generalizzata, è esprimibile dalla densità di corrente elettrica (A/m2) che passa tra catodo ed anodo o dalla variazione di peso dell’anodo nell’unità di tempo e di superficie (mg/dm2 giorno) o di perdita di spessore dell’anodo nell’unità di tempo (mm/anno).


La corrosione si manifesta anche in presenza di un solo metallo grazie alla formazione sulla superficie del metallo di microzone anodiche e catodiche che cambiano di posizione casualmente nel tempo e nello spazio.
Macroscopicamente si ottiene un attacco corrosivo generalizzato del metallo.

• Metodi cinetici: permettono di agire direttamente sulla velocità di corrosione. In tale categoria possono essere ricordati:
- l’impiego degli inibitori;
- l’impiego dei rivestimenti;
- in una certa misura, la passivazione anodica, in cui il metallo viene portato nelle sue condizioni di passivazione, ovvero riesce a formare uno strato uniforme, sottile, compatto, ed aderente di ossido superficiale che svolge un ruolo protettivo.
• Metodi termodinamici: essi consistono nel far “funzionare” il metallo in condizioni di immunità. Si possono citare in tale categoria:
- la scelta del metallo;
- la protezione catodica, che permette di posizionare il metallo nella sua zona di immunità.
Si possono utilizzare:
• Rivestimenti metallici, ottenuti per:
- elettrolisi (Zn, Ni, Cr, Cu, Cd, ...)
- immersione (Zn, Sn, Al)
- diffusione di un elemento di lega (Zn, Al)
- placcatura, su prodotti piani durante la laminazione a caldo (saldatura per diffusione). Sono placcati anche su acciaio al carbonio: acciai inossidabili, ottone, nickel, cupro-nickel, rame, ... .
• Rivestimenti non metallici
- pitture, vernici contenenti eventualmente degli inibitori di corrosione;
- smalti, vetri;
- materie plastiche, gomme;
- fosfatazione;
- ossidazione anodica (Al) oppure chimica (Mg).
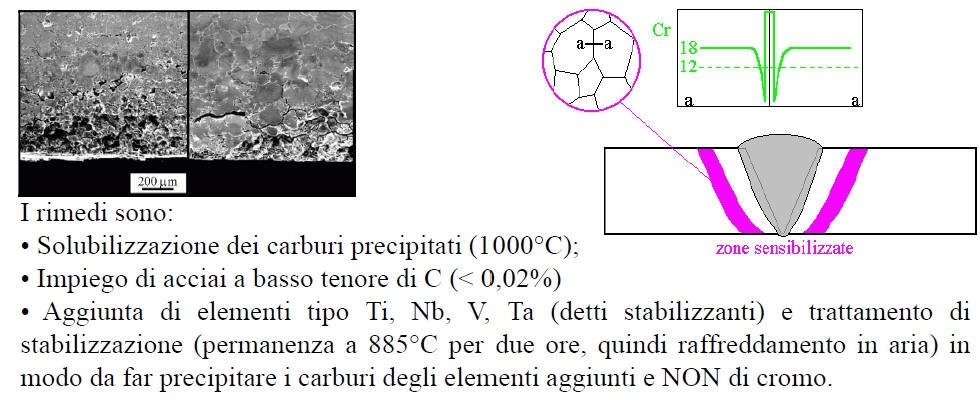
Gli acciai inossidabili sono così denominati grazie alla loro caratteristica resistenza alla corrosione, dovuta alla formazione di un film protettivo passivante legato alla presenza del p g p Cr. Diversi sono i parametri che influenzano la resistenza alla corrosione degli acciai inossidabili:
• acidità del mezzo aggressivo (pH);
• tenore in ioni alogenuri (essenzialmente Cl-);
• potere ossidante della soluzione aggressiva;
• temperatura.
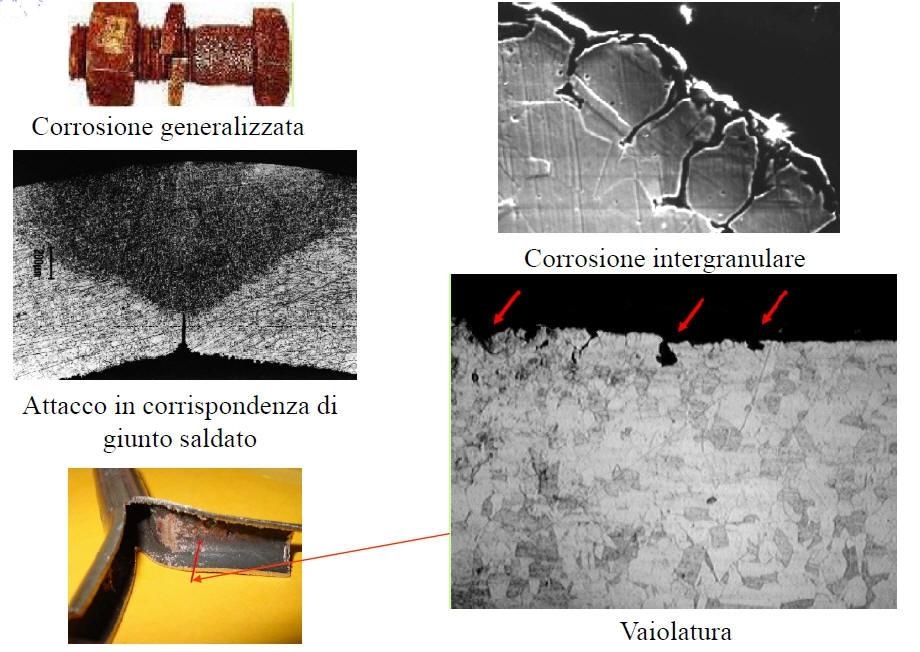
Questi acciai hanno una buona resistenza alla corrosione generalizzata, dipendente dalla loro composizione chimica, ma risultano sensibili ad alcune forme di corrosione localizzata:
•Vaiolatura (pitting);
•Corrosione cavernosa;
•Corrosione sotto sforzo;
•Corrosione intergranulare
Affinché si possa avere si debbono verificare contemporaneamente le tre seguenti condizioni:
•Ambiente ossidante
•Presenza di ioni alogenuri (ad esempio Cl-)
•Metallo passivabile (ad esempio acciaio inossidabile)
Caso tipico è quello di strutture in acciaio inossidabile austenitico immerse in acqua di mare (ambiente ossidante contenente ioni Cl-)
Attacco corrosivo localizzato in cui fenomeni di idrolisi, diminuzione del pH e la presenza degli ioni Cl- giocano un ruolo importante.
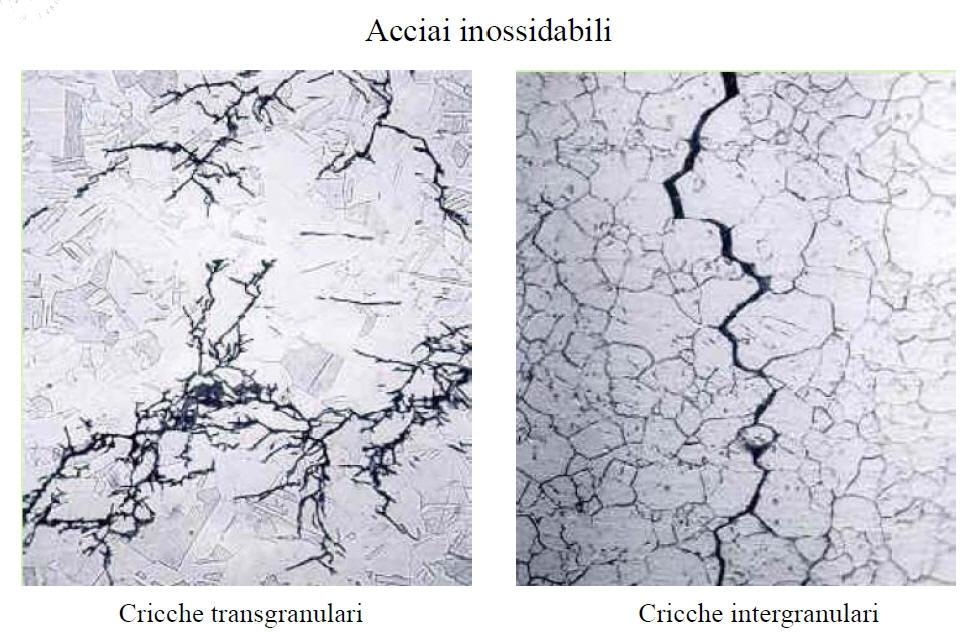
La corrosione sotto sforzo avviene ogni qual volta si hanno degli sforzi (esterni, residui post-saldatura, dovuti a trattamenti meccanici o termici ...) in presenza di ambienti clorurati. Gli acciai inossidabili austenitici subiscono in queste condizioni una fessurazione transgranulare piuttosto importante, mentre gli acciai inossidabili ferritici sembrano essere meno sensibili a questo tipo di corrosione.

Affinché si abbia questa forma di attacco corrosivo il metallo deve subire un processo corrosivo, di sensibilizzazione ovvero permanere per tempi sufficienti a temperature comprese fra 500 ed 800°C, con conseguente precipitazione a bordo grano di carburi di Cromo del tipo Cr23C6. Nel caso questa precipitazione sia molto spinta si può avere una depassivazione di queste zone, che divengono anodiche al contatto con il mezzo aggressivo. Un caso tipico è quello della corrosione intergranulare nelle zone sensibilizzate nel caso di saldatura di acciai inossidabili.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-013 - Lucidi del corso di "Metallurgia" sono disponibili in formato pdf all’indirizzo: http://www.metallurgia.unicas.it