Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Metallurgia dei metalli e delle leghe
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-H02 - Metallurgia - Pag. ATS-H02.02
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
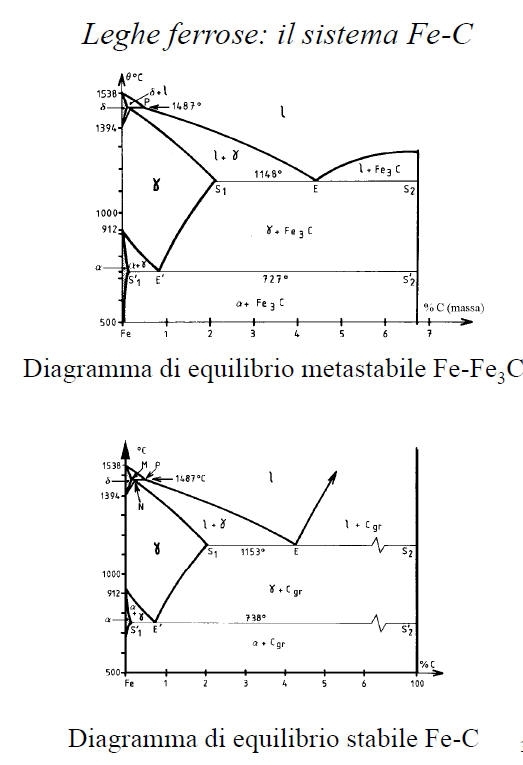
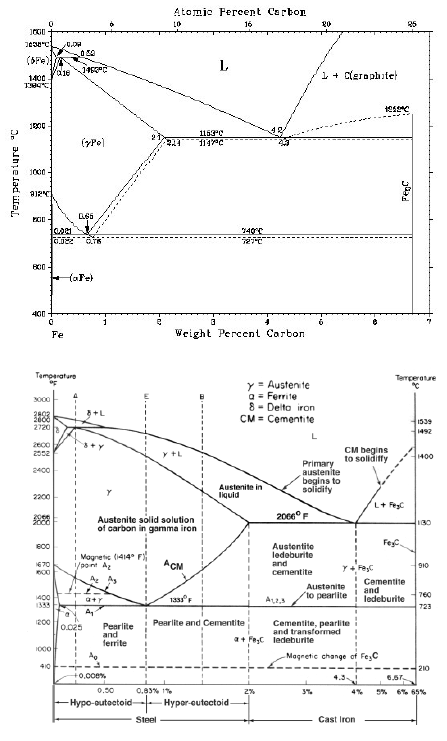
ferro
a (solubilità max pari a 0.02% a 727°C); il reticolo è CCC;• Ferrite
d: soluzione solida interstiziale di C nel ferro d (solubilità max pari a 0.1% a 1487°C); il reticolo è CCC;• Austenite
g: soluzione solida interstiziale di C nel ferro g; il reticolo è CFC;• Martensite: soluzione solida sovrassatura di C nel ferro a reticolo tetragonale corpo centrato;
•
Cementite (Fe3C): la sua composizione corrisponde ad un tenore del 6.67% in C. Si tratta di un composto interstiziale a maglia ortorombica; è metastabile e tende a decomporsi in ferrite (oppure austenite) e grafite secondo la reazione Fe3C -> 3Fe + Cgr• Carbonio puro (grafite) Cgr: la solubilità del Fe nel Cgr è nulla





I materiali metallici, a contatto con ambienti aggressivi liquidi o gassosi, tendono a raggiungere uno stato termodinamicamente più stabile. Le reazioni che ne conseguono si manifestano con il fenomeno di corrosione.
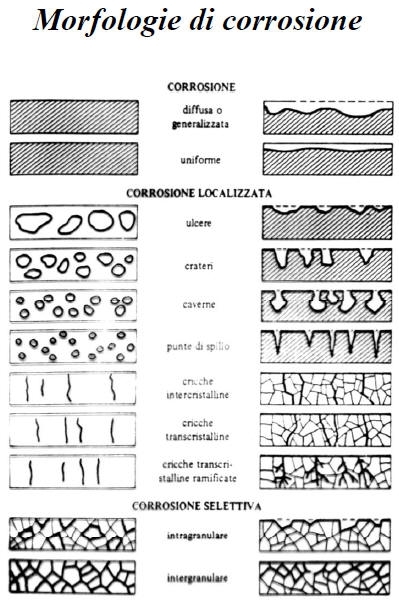
Si possono distinguere:
• corrosione chimica (o a secco, oppure ossidazione): si ha in ambienti privi di acqua allo stato di liquido o di vapore, ad alta temperatura
• corrosione elettrochimica ( o ad umido): si ha in ambienti che presentano acqua allo stato liquido o di vapore
Nel seguito ci occuperemo prevalentemente della corrosione ad umido, distinguendo la corrosione generalizzata dai vari casi di corrosione localizzata
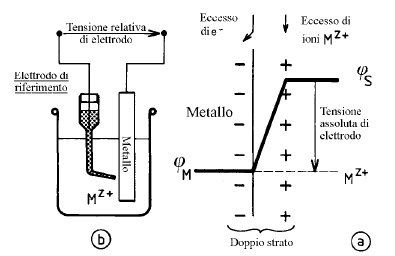
Un elettrodo è una fase, il più delle volte metallica, in contatto con un elettrolita. L’insieme metallo-soluzione è spesso chiamato elettrodo per estensione.
Esempi:
1) Una lamina di rame in contatto con una soluzione di sale rameico costituisce un elettrodo;
2) Dell’idrogeno adsorbito su una lamina di platino in contatto con una soluzione acida costituisce un elettrodo;
3) Una struttura in acciaio immersa in acqua di mare costituisce un elettrodo.
Nei casi 1) e 2), che fanno intervenire un solo sistema elettrochimico (Cu/Cu+2 oppure H2/H+), si stabilisce spontaneamente una differenza di potenziale (d.d.p.) fra il metallo e la soluzione denominata tensione d’elettrodo all’equilibrio, che è caratteristica del sistema studiato.


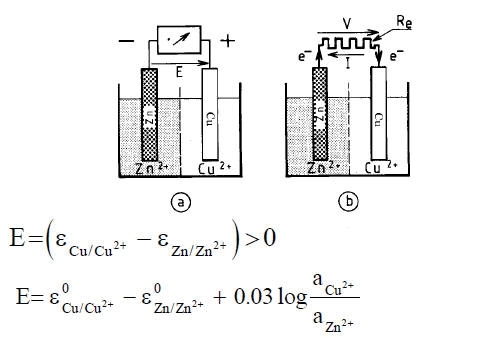
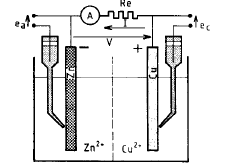
All’elettrodo di Zn ha luogo la reazione: Zn -> Zn2+ + 2e-
All’elettrodo di Cu ha luogo la reazione: Cu2+ + 2e- -> Cu
Globalmente si ottiene: Cu2+ + Zn -> Cu + Zn2+ con il rame che si riduce e lo zinco che si ossida.
-
L’elettrodo di zinco, ove ha luogo una ossidazione, è un anodo.
-
L’elettrodo rame, ove ha luogo una riduzione, è un catodo.
Se si suppone che la resistenza Re tende ad annullarsi, la cella galvanica è in corto circuito, e V tende anch’esso ad annullarsi.
Questa condizione è, ad esempio, ottenuta considerando un sistema metallico costituito da un pezzo di zinco in contatto con un pezzo di rame, immersi in una soluzione contenente Cu2+ e Zn2+.
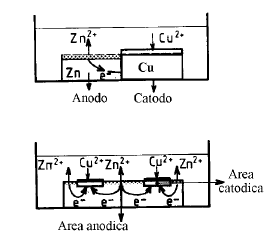
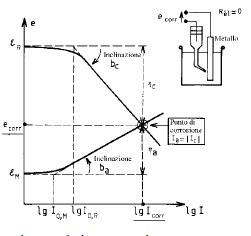
Un sistema metallo-elettrolita in cui si sta sviluppando un fenomeno corrosivo appare quindi come una cella galvanica in corto circuito: le zone anodiche si corrodono ed il metallo subisce una ossidazione. La massa metallica è equipotenziale e, se si può trascurare la caduta ohmica nell’elettrolita, le zone anodiche e catodiche sono caratterizzate da una tensione d’elettrodo comune denominata tensione di corrosione
Generalizzando la teoria delle pile localizzate, si può dire che la condizione necessaria perché un metallo si corroda (sistema fornitore di elettroni), è che esista un sistema accettore di elettroni in grado di scambiare elettroni con tale metallo. Tali sistemi accettori esistono in generale negli elettroliti. Nel caso delle soluzioni acquose i più importanti sono:
-
La riduzione dei protoni: 2 H+ + 2 e- -> H2
-
La riduzione dell’ossigeno disciolto: O2 + 2 H2O + 4 e- -> 4 OH
Ad esempio, per una lamina in ferro in contatto con una soluzione acida (a pH = 1), di attività 10-6 mol/l in Fe2+, il sistema donatore che può essere preso in considerazione è:
εM = - 0.44 + 0.03 log 10-6 = - 0.62 V/SHE
Il sistema accettore che può essere preso in considerazione è:
εR = 0.00 - 0.06 pH - 0.03 log pH2 (atm)
εR = 0.00 - 0.06 x 1 = - 0.06 V/SHE
(considerando pH2 = 1 atm, pressione di formazione delle bolle di gas).
Quindi in tale caso εR > εM , e la corrosione è termodinamicamente possibile ed avverrà secondo la reazione:
Fe + 2 H+ -> Fe2+ + H2
E’ la rappresentazione isotermica della evoluzione e(pH) per una composizione determinata, cioè con concentrazioni molari delle specie ioniche in soluzione fissate: è normale scegliere 10-6 mol/l per le specie ioniche nei problemi di corrosione (a meno che esse abbiano dei valori sperimentali noti).
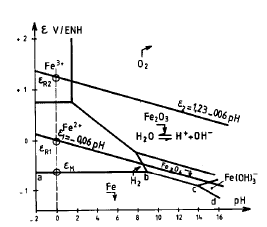
- la frontiera ab corrisponde all’equilibrio:

Il dominio di stabilità dell’acqua è delimitato dalle seguenti frontiere:
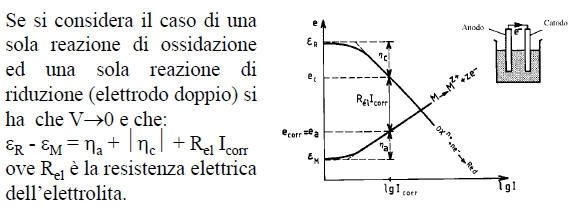
- ec ed ea sono differenti dalle tensioni di equilibrio ec ed εa a corrente nulla.
- ec ed ea dipendono dalla corrente che passa attraverso la cella.
Le curve ec(I) ed ea(I) sono le curve di polarizzazione anodica e catodica.
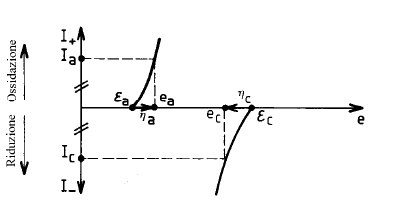
Si introduce spesso la sovratensione h, definita come: h = eI¹0 - eI=0
La sovratensione anodica ha = ea - ea è sempre positiva.
La sovratensione catodica hc = ec - ec è sempre negativa.
Le curve di polarizzazione saranno ben descritte anche da mc(I) ed ma(I)
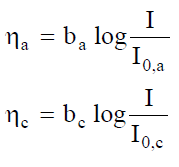
Esempio: per la reazione di riduzione dei protoni:
2 H+ + 2 e- ® H2
bc = - 0.12 V
I0 = 10-13 A cm-2 sul Pb e 10-3 A cm-2 sul Pt.
In effetti in certi casi le correnti sono limitate da fenomeni di trasporto per diffusione delle specie chimiche reagenti. Le curve di polarizzazione sono allora caratterizzate da una corrente I; detta corrente limite la cui intensità è proporzionale alla concentrazione della specie che diffonde nell’elettrolita.
Il diagramma di Evans di un sistema sotto corrosione è la rappresentazione nel piano e-logI oppure e-I delle curve di polarizzazione anodica (ossidazione del metallo) e catodica (riduzione dell’accettore di elettroni), quest’ultima riportata nel semi piano anodico.
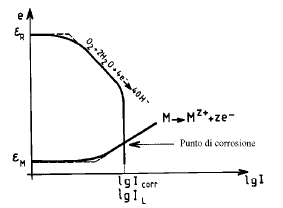
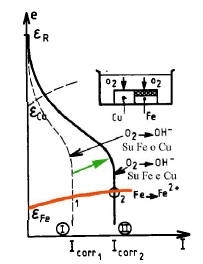
Due aree uguali di Fe e Cu sono in contatto elettrico e sono bagnate da una soluzione neutra areata nella quale l’ossidante è l’O2 disciolto.
Due aree uguali di Fe e di Pt sono in contatto elettrico e sono bagnate da una soluzione acida. La reazione di riduzione è quella dei protoni.

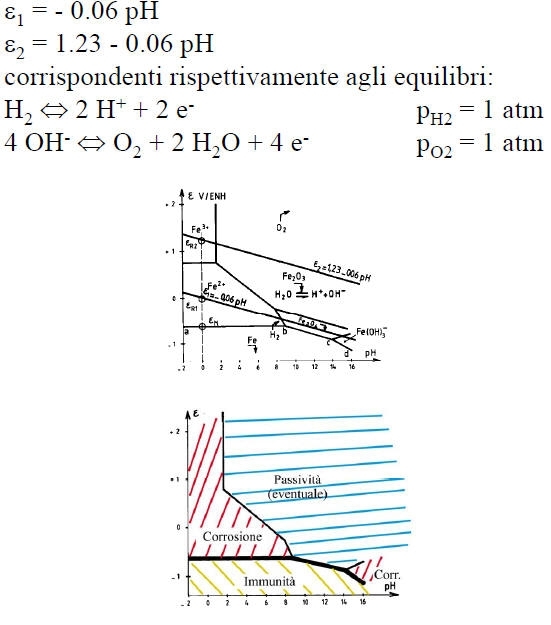
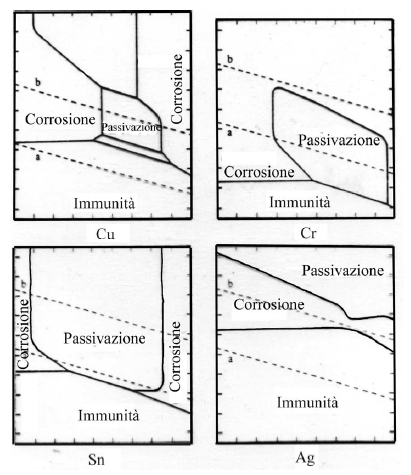
La passivazione di un metallo comporta la trasformazione di una superficie attiva in via di corrosione in una quasi inattiva, grazie alla formazione di uno strato di passivazione.
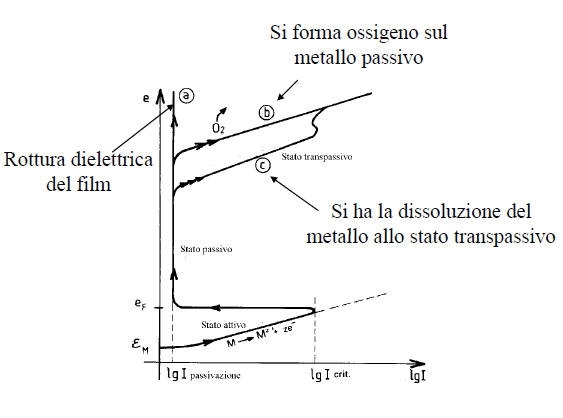
Per portare un metallo nel suo dominio di passivazione si può utilizzare un potenziostato che impone al metallo un valore di tensione opportuno.
Si può anche utilizzare un ossidante in condizioni tali che il punto di corrosione del sistema sia nel dominio di passivazione del metallo: la corrosione avverrà quindi ad una velocità estremamente bassa corrispondente a Ipassiv. In tale caso è necessario che eR > eF e I abbia potuto raggiungere il valore Icrit prima di fissarsi a Ipassiv.
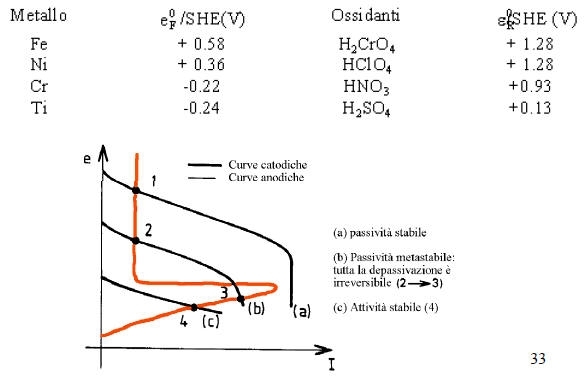
-
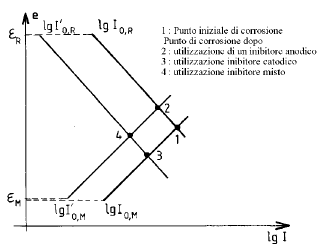
Metodi cinetici: permettono di agire direttamente sui parametri cinetici: densità di corrente di scambio anodica e catodica I0,a e I0,c , coefficienti di Tafel anodici e catodici ba e bc, aree anodiche e catodiche Sa e Sc. In tale categoria possono essere ricordati:
- l’impiego degli inibitori;
- l’impiego dei rivestimenti;
- in una certa misura, la passivazione anodica.
Metodi termodinamici: essi consistono nel diminuire eR - eM, fino addirittura a rendere tale differenza negativa. Si possono citare in tale categoria:
- la scelta del metallo;
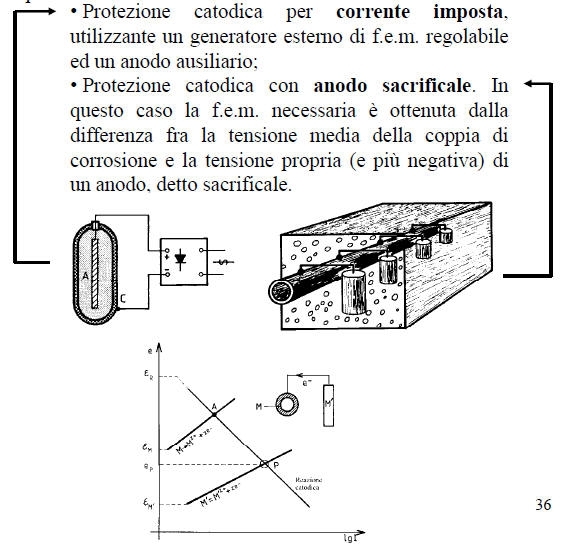
- la protezione catodica, che permette di posizionare il metallo nella sua zona di immunità.
Si possono distinguere:
-
Rivestimenti metallici, ottenuti per:
- elettrolisi (Zn, Ni, Cr, Cu, Cd, ...)
- immersione (Zn, Sn, Al)
- diffusione di un elemento di lega (Zn, Al)
- placcatura, su prodotti piani durante la laminazione a caldo (saldatura per diffusione). Sono placcati anche su acciaio al carbonio: acciai inossidabili, ottone, nickel, cupro-nickel, rame, ... .
-
Rivestimenti non metallici
- pitture, vernici contenenti eventualmente degli inibitori di corrosione;
- smalti, vetri;
- materie plastiche gomme;
- plastiche,
- fosfatazione;
- ossidazione anodica (Al) oppure chimica (Mg).
Essa consiste nell’aumentare la tensione metallo-ambiente in modo da portarlo nella sua zona di passivazione.
• L’impiego di catodi statici, convenientemente distribuiti sulla struttura da proteggere e costituiti da metalli più nobili.
• L’impiego di un potenziostato che porta la struttura al di sopra della tensione di Flade e la mantiene fra i due limiti di passivazione.
Essa consiste nell’abbassare la tensione metallo-ambiente in modo da portarla nella zona di immunità.
Corrosione per aereazione differenziale.
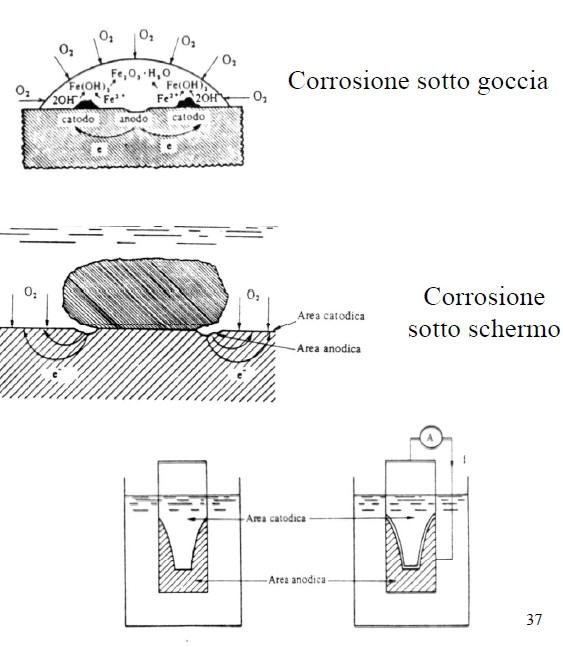
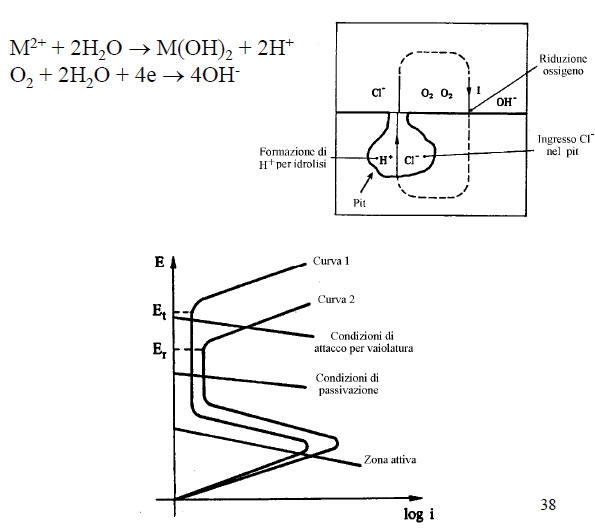
E’ una forma di corrosione estremamente insidiosa e può avere luogo solo se si verificano contemporaneamente le seguenti condizioni:
• Metallo attivo-passivo
• Ambiente ossidante
• Presenza di ioni alogenuri (Cl-, F-…)
Tale forma di attacco corrosivo localizzato si ha nel caso in cui l’ambiente penetra in interstizi (0.025-0.1 mm) delle superfici di leghe metalliche passivabili (intagli, saldature porose, collegamenti filettati...).
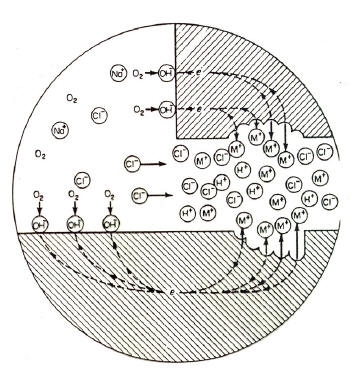
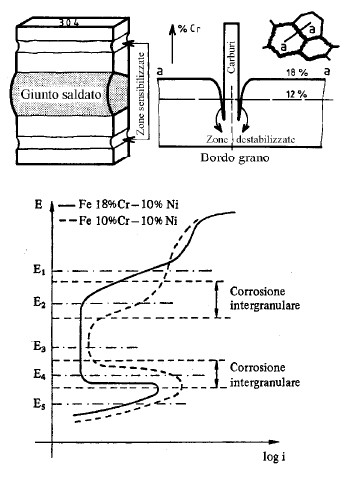
• Forma di corrosione tipica degli acciai inossidabili austenitici
• Si ha in seguito alla sensibilizzazione del metallo (permanenza per tempi più o meno lunghi a 600-700°C)
• La sensibilizzazione di un acciaio consiste nella precipitazione a bordo grano di carburi di Cr in quantità tale che il tenore di Cr libero scende al di sotto del limite di inossidabilità del 12%.
• E’ un problema tipico dei giunti saldati in corrispondenza della ZTA.
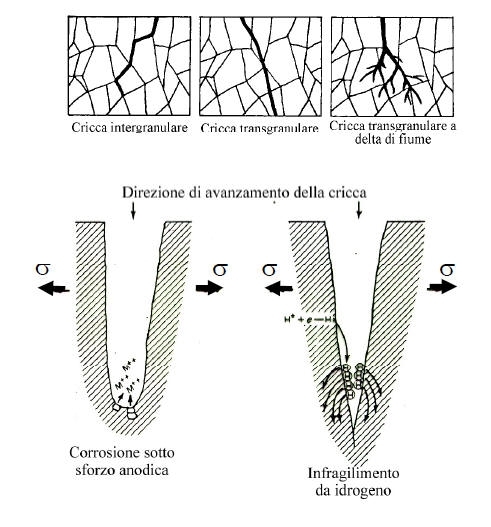
La corrosione sotto sforzo ha luogo nei casi in cui ambienti blandamente aggressivi, oppure completamente non aggressivi, interagiscono con uno stato di sollecitazione, con la formazione di cricche che possono evolvere fino alla rottura del pezzo.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-013 - Lucidi del corso di "Metallurgia" sono disponibili in formato pdf all’indirizzo: http://www.metallurgia.unicas.it