Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Metallurgia dei metalli e delle leghe
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-H02 - Metallurgia - Pag. ATS-H02.01
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
FASE: Regione omogenea di un sistema.
SISTEMA ETEROGENEO
: Sistema costituito da due o più fasi. L’attraversamento delle superfici che separano le fasi comporta una variazione discontinua di almeno una variabile intensiva (p.e. densità, concentrazione degli elementi).GENERICA REAZIONE CHIMICA:
aA + bC + ……
⇔ mM + nN + ….Q = calore di reazione
Q
p = calore di reazione a pressione costanteQv = calore di reazione a volume costante
Si ricorda che:
Energia libera
(G): G = U + PV-TS
ove U è l’energia interna del sistema. Essa è una funzione di stato (dipende unicamente dallo stato in cui il sistema si trova e non da come a tale stato si sia pervenuti).
Δ
S = Q rev > irrS è l’entropia del sistema (anch’essa è una funzione di stato)
Se si considera una trasformazione
A → B durante il quale il sistema può compiere solo lavoro di tipo PV, e si definisce ΔG =GB - GASe la trasformazione procede spontaneamente ed irreversibilmente fino all’equilibrio:
Δ
G < 0Δ
G = 0 La trasformazione è all’equilibrio (non procede)Δ
G > 0 La trasformazione non avvieneSe gli scambi di lavoro sono solo quelli per variazione di volume
Δ
U = Qp - PΔV ⇒ ΔG = QP - TΔS
Se la reazione avviene fra sostanze allo stato condensato, a T non eccessiva, senza cambiamenti di stato o trasformazioni allotropiche
ΔG = QP
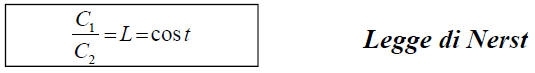
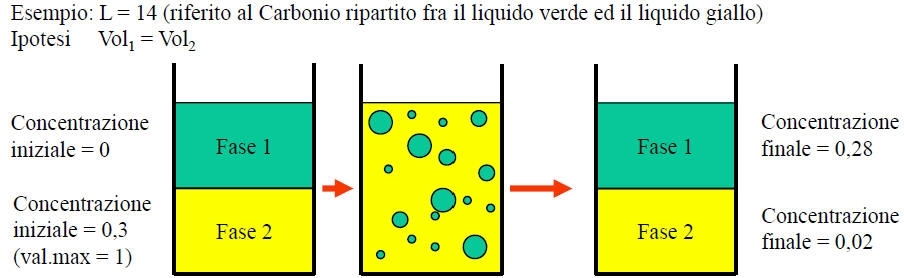
Legge ripartizione
• consideri un sistema eterogeneo formato da due fasi
• Il componente X è in quantità tale che, all’equilibrio, esso raggiunge le concentrazioni C1 e C2
• Il componente X conserva nelle due fasi lo stesso peso molecolare
Regola delle fasi (Teorema di Gibbs)
In condizioni di equilibrio e di configurazione fisica prefissata
Grado di libertà =
ν = ci + m - fove
c
i = numero dei componenti indipendentim = numero dei fattori fisici
f = numero delle fasi presenti

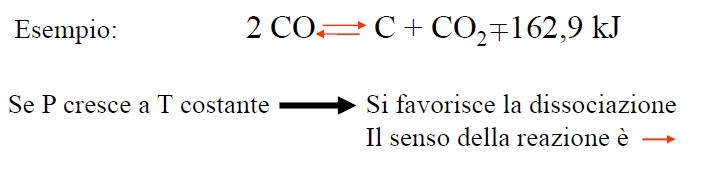
Se in un sistema chimico fisico qualsiasi, in condizioni di equilibrio stabile, si fa variare uno dei fattori di equilibrio La trasformazione che ha origine avviene in senso tale da opporsi alla variazione del fattore considerato, cioè tende a spostare l’equilibrio in modo da annullare la variazione imposta
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-013 - Lucidi del corso di "Metallurgia" sono disponibili in formato pdf all’indirizzo: http://www.metallurgia.unicas.it