Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà e metallurgia del Bronzo
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G10 - Proprietà metalli - Pag. ATS-G10.07
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Gli oggetti di bronzo, e, in modo particolare le campane, esposte all'aria e alla azione degli agenti esogeni, si ossidano e possono anche corrodersi. Esaminiamo i vari tipi di ossidazione protettiva (detta patina) e ossidazione corrosiva (detta cancro del bronzo
).A prescindere dall’importanza storica ed iconografica, gran parte del fascino di dei manufatti di bronzo (monete, oggetti, campane, ecc.) dipende dalla patina multicolore che a volte si crea sulla loro superficie e che rende ogni oggetto un reperto unico e irripetibile, diverso da ogni altro come sono diversi tra loro le impronte digitali o i volti degli uomini.
La patina deriva dall’interazione del supporto originario con l’ambiente circostante. Nell’interfaccia tra oggetto ed ambiente si verificano processi di corrosione chimica ed elettrochimica che determinano un’alterazione della superficie stessa dell'oggetto. Il risultato di questi processi corrosivi superficiali, protratti per secoli o per millenni, viene definito patina.
Più propriamente la patina è uno strato composito di prodotti di corrosione che contengano ancora, almeno parzialmente, informazioni e profili della superficie originaria.
I fattori che attivano i processi di corrosione sono: l’aria (ossigeno), l’acqua (che permette fenomeni di natura elettrochimica) e il suolo con i suoi componenti solforati, carbonati, gli acidi, i cloruri e gli agenti ossidanti. Ricordiamo infine il materiale organico e le alte temperature.
La patina viene poi modificata da tutti quegli interventi, propri od impropri, apportati allo scopo di restauro o manutenzione, con l’applicazione di olii, cere o vernici protettive. Infine non ultimo l’esposizione all’aria espone le delicate patine ad agenti inquinanti che possono essere presenti negli ambienti urbani.
Quando una patina è nobile, uniforme e liscia, essa conserva magnificamente l'oggetto, lo impermeabilizza, e gli conferisce quel fascino del tempo che ogni studioso impara ad apprezzare. Una bella patina può incrementare il valore dell'oggetto fino al 100% e anche di più.
Il primo e più semplice fenomeno corrosivo cui va incontro il rame è l’ossidazione. Il composto che deriva dall’interazione tra rame ed ossigeno è l’ossido di rame o
CUPRITE Cu2O

Bel cristallo puro di cuprite (5mm, Arizona)
Il colore della cuprite è rosso/bruno. La cuprite è meno densa del rame originario ed occupa un volume maggiore. La variazione volumetrica della superficie è un aspetto molto importante, si sa che le patine “crescono”, ma una spropositata crescita della patina altera ed oblitera i rilievi originari ed i dettagli dell'oggetto.
Il rapporto tra il volume del rame originario e l’ aumento di volume prodotto dai fenomeni di corrosione è espresso dal volume molare relativo (VMR). Il VMR indica l’accrescimento volumetrico della patina stessa. Posto 1 il volume iniziale del rame, la cuprite presenta un VMR di 1,67, molto basso (rispetto ad altre patine). Questo significa che la cuprite non altera in modo significativo la superficie dell'oggetto e ne preserva pressoché inalterati i rilievi ed i dettagli.
Se invece si forma un legame stabile tra un solo atomo di rame ed un atomo di ossigeno, si forma la
TENORITE (CuO)
La tenorite è grigio nera e presenta un VMR basso. La tenorite è il tipo di ossidazione più tipico delle campane.
Un altro processo frequente negli oggetti bronzei interrati, è il contatto del rame con il carbonio, con la conseguente formazione di carbonati rameici. Le possibili combinazioni danno vita a tre composti:
MALACHITE CuCO3Cu(OH)2 (VMR 4)
AZZURRITE 2CuCO3Cu(OH)2 (VMR 3.88)
CALCONATRONITE Na2(CuCO3)23H2O
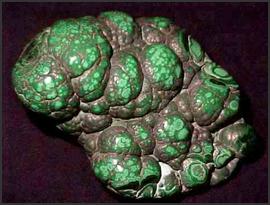 |
 |
| Noduli grezzi di malachite naturale, leggermente lucidato in superficie | Azzurrite in cristalli |
La malachite è di un bel verde intenso, la classica patina verde oliva. L’azzurrite è blu, la calconatrite un verde/blu. Si tratta delle cosiddette “patine nobili”. Come intuibile dal valore elevato di VMR le patine a base di carbonati sono molto sviluppate in volume, fenomeno che potrebbe ripercuotersi nella leggibilità dei dettagli. La patina di malachite richiede acqua e un suolo ricco di anidride carbonica.
 |
 |
| Patina di cuprite (rossa) alternata a malachite (verde) di diverse tonalità su un manufatto in rame di età romana. | dettaglio dell’immagine di fianco |
Un terzo tipo di interazione avviene con il cloro. In presenza di suoli acidi e di cloruro di sodio la reazione con il rame genera cloruro di rame:
NANTOKITE CuCl (VMR 3.36)
La nantokite è un prodotto instabile che tende a generare rapidamente altra nantokite con una reazione che tende ad estendersi spontaneamente. La corrosione provocata dalla nantochite è profonda e produce una polverina verde chiaro nella quale si sbriciola la superficie dell'oggetto, condizione altrimenti nota come
cancro del bronzo (bronze disease nel mondo anglosassone). La reazione che genera il cancro del bronzo è complessa e non facilmente riassumibile. E’ richiesta la presenza di cloro in ambiente acquoso.

Cancro del bronzo su un manufatto egiziano
Infine il contatto con suoli sulfurei genera solfuri di rame:
CHALCOCITE Cu2 S
BROCHANTITE CuS04 CU(OH)2
La chalcocite è nera mentre la brochantite è verde. Il VMR della Chalcocite (1.99) è piuttosto basso.

1:
disegno schematico di come si stratifichi la patina su un oggetto. La parte
più interna è generalmente uno strato di cuprite rosso/bruno
2: fenomeno del “bending”, strati di cuprite e malachite alternati tra
loro sulla superficie di un oggetto.
Diverse patine possono essere presenti sullo stesso oggetto. In linea di massima la cuprite occupa lo strato più interno mentre la malachite quello più esterno. Un fenomeno particolare è quello del bending, ovvero l’alternarsi di cuprite e malachite. Il crearsi nel corso del tempo di condizioni aerobie ed anaerobie potrebbe essere responsabile di questo fenomeno stratigrafico per cui strati di cuprite e di malachite risultano alternati tra loro.
| REAZIONE | COLORE |
TIPO DI
AMBIENTE (e/o suolo per gli oggetti interrati) |
VMR | |
|
Cuprite |
Ossido | Rosso / Bruno | arieggiato e aerobico | 1.67 |
| Tenorite | Ossido | Nero | arieggiato e aerobico | 1.75 |
| Malachite | Carbonato | Verde chiaro | ricco di anidride carbonica e umido | 3.88 |
| Azzurrite | Carbonato | Blu / azzurro | ricco di anidride carbonica e umido | 4.16 |
|
Calchonatronite |
Carbonato | Verde scuro / blu | ricco di anidride carbonica e umido | - |
| Nantochite | Cloruro | Verdino chiaro polveroso | Umidi e ricchi di cloro e sali | 3.36 |
|
Atacamite |
Cloruro basico | Verde | Umidi e ricchi di cloro e sali | 3.99 |
| Paratacamite | Cloruro basico | Verde chiaro | Umidi e ricchi di cloro e sali | 3.99 |
| Bollachite | Cloruro basico | Verde chiaro / blu | Umidi e ricchi di cloro e sali | - |
| Chalcocite | Solfuro | Nero | Ricchi di zolfo, sorgenti solfuree | 1.99 |
| Brochantite | Solfuro | Verde | Ricchi di zolfo | 4.20 |
|
Tevere |
Ossido | Beige chiaro | Stazionato in acqua | - |
Gli oggetti bronzei rimangono generalmente a contatto con l’aria. Nel caso gli oggetti siano riparati dall’inquinamento e vengano tenuti in ambienti asciutti, il fenomeno che procede è una ossidazione del rame che genera cuprite (Cu2O).
Se però sulla superficie dell'oggetto si crea un velo di acqua, non visibile ad occhio nudo, ma derivante dalla condensazione del vapore acqueo contenuto nell’atmosfera, potrebbero innescarsi fenomeni di corrosione elettrochimica, fino a vero e proprio cancro del bronzo, qualora fossero presenti sali di cloro nella patina.
L’inquinamento delle grandi città attacca le preziose patine, permettendo che esse vengano raggiunte da acido solfidrico, in grado di innescare patine di corrosione secondarie sia marroni che nere. Inoltre l’inquinamento può determinare alterazioni dell’acidità superficiale dell'oggetto, con valori tra 3 e 5 di pH, generando atacamite, clorato di rame molto pericoloso.
La caratteristica patina del bronzo non era sconosciuta nell’antichità. Già i romani conoscevano le alterazioni prodotte dagli agenti atmosferici sul bronzo esposto all’aperto. I ricchi collezionisti nell’antica Roma tardo repubblicana ed imperiale erano esperti anche di patine, come provato da Plinio il Giovane “Aes ipsum quantum verus color indicat, vetus et antiquum”: la patina era garanzia di autenticità e di antichità del manufatto. (Aepistulae III, 6,3).
Frequenti anche i riferimenti alla patinatura dei metalli, sia a scopo conservativo che estetico. “Gli egizi colorano l’argento” diceva con un certo sconcerto Plinio il Vecchio (NH XXXIII, 131) e descrive delle applicazioni di zolfo in grado di provocare la formazione di solfuro d’argento in superficie.
Meccanismi analoghi consentono ancora oggi di scurire i denari d’argento creando in superficie una patina intensamente bruna di solfuro d’argento.
Sempre Plinio parla del “bitumen” per rivestire le statue di bronzo affinché “si coprano più rapidamente di verderame”. In oggetti archeologici è stata riscontrata una patina d’epoca forse artificiale. Sia sulla statua A di Riace che sull’efebo di Maratona è stato trovata Chalcocite (solfuro di rame), una patina nera molto compatta, ottenibile trattando la statua con prodotti sulfurei, come suggerito dagli Egizi.
Infine il bronzo delle statue importanti veniva dorato. La doratura era applicata mediante laminatura di un sottilissimo foglio d’oro sulla statua, ne sono esempio il Marco Aurelio e l’Ercole del Palazzo dei Conservatori.
Spesso per evidenziare particolari come fregi, ritratti o legende alcuni restauratori con poca esperienza incidono le preziose patine utilizzando bisturi o bulini, rovinando irreparabilmente gli oggetti.
Come già accennato precedentemente il cancro del bronzo è una terribile corrosione che colpisce gli oggetti in bronzo, agisce sulla patina e il metallo trasformandoli in una polverina verde azzurrognola di consistenza variabile.
Proprio come i medici, i chimici, si prendono cura di reperti altrimenti destinati a ridursi in polvere. Non solo. L'attenzione dei chimici è rivolta anche agli operatori del settore, che spesso, per somministrare con il loro pennello i «farmaci», lavorano a contatto con prodotti dannosi per la salute.
Per prima cosa, si analizza lo stato dei reperti composti da leghe a base di rame, come appunto il bronzo, tramite sofisticati strumenti, tra cui la spettroscopia di fotoemissione indotta dai raggi X.
In questo modo si riesce a fare una diagnosi completa sulle cause di corrosione.
E proprio tramite metodi di indagini innovative che i ricercatori riescono a diagnosticare e studiare il «tumore del bronzo», una malattia che si manifesta con macchie verdastre che in breve tempo porta il manufatto metallico alla completa mineralizzazione.
Proprio come il tumore per l'uomo, quello del bronzo provoca una reazione a catena che diffonde i prodotti di corrosione come se fossero delle metastasi. Il fenomeno di degrado è causato dal cloruro rameoso, che si forma per interazione dell’oggetto. Finché è ben protetto, l'oggetto si trova in una condizione di equilibrio chimico-fisico, ma dopo il contatto con l’ossigeno e l’umidità dell’aria, subisce reazioni di degrado.
L’unico efficace trattamento è all’applicazione di inibitori, cioè soluzioni che trasformano i prodotti corrosivi in sali meno sensibili alle condizioni ambientali, chimicamente più stabili e meno soggetti a trasformazioni chimiche.
L’inibitore più usato è il benzotriazolo utilizzato da tempo per il trattamento anticorrosivo di qualsiasi oggetto in rame in soluzione alcolica al 6-7%. Il trattamento consiste nell’immergere l'oggetto nella soluzione per almeno 4 ore sotto una cappa aspirante (il benzotriazolo è una sostanza altamente tossica). In seguito risciacquarlo in acqua demineralizzata per almeno un’ora. Asciugarlo con un panno morbido e tenerlo in osservazione per alcuni giorni.
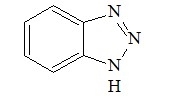
formula chimica del benzotriazolo
Tuttavia il benzotriazolo (Bta), oltre a non essere sempre efficace, è sospettato di essere cancerogeno.
Da qui la necessità di trovare prodotti efficaci quanto il Bta, ma non pericolosi per l'operatore del restauro. Il lavoro dei chimici è, appunto, quello di sviluppare molecole in grado di rispondere a entrambe le esigenze. Proprio come i farmaci, i prodotti sintetizzati in laboratorio seguono un protocollo ben preciso prima di poter essere utilizzati su un reperto prezioso.
C'è la fase 1, in cui il prodotto viene testato su materiali di riferimento di lega moderna, opportunamente sintetizzati, ma molto simili nella composizione agli oggetti originari e su campioni adeguatamente corrosi.
Poi si passa alla fase 2, cioè alla sperimentazione del prodotto su reperti veri, ma considerati di «scarto».
Solo dopo aver superato con successo tutte queste fasi il prodotto viene validato ed approvato per l'utilizzo.
Al momento sono stati sviluppati e testati una decina di potenziali «farmaci» per il bronzo.
Ma l'obiettivo degli scienziati è quello di creare terapie personalizzate per ogni reperto, trattamenti che tengano conto non solo del materiale di cui è composto il manufatto, ma anche del contesto in cui è stato conservato e, quindi, del conseguente degrado.
Una molecola organica, messa a punto dall'Ismn del Consiglio nazionale delle ricerche, bloccando la 'metastasi' del male permette di recuperare il manufatto: la DM02, in grado di arrestare il processo di deperimento.
Una buona notizia per i restauratori. Presto avranno a disposizione un 'farmaco' più efficace per sconfiggere il 'tumore' del bronzo.
Basta invece una piccola quantità di DM02 per avere buoni risultati: l’antidoto viene spalmato con un pennello direttamente sulla parte 'malata' a concentrazioni dalle 30 alla 100 volte inferiori a quelle del benzotriazolo; essendo efficace in piccole dosi, la DM02 assicura anche un minor pericolo di tossicità.
L'obiettivo è realizzare composti efficienti e non pericolosi per l’uomo, che agiscano attraverso meccanismi nanoscopici completamente diversi. Sulla base di una vasta esperienza acquisita dallo studio del meccanismo di degrado dei bronzi antichi si è modificata una molecola organica, facendo in modo che essa fosse in grado di agganciarsi alla superficie del manufatto e di bloccare la reattività del cloruro rameoso.
Viene così arrestata 'la metastasi' delle pericolose macchie verdastre.
I test condotti hanno verificato su alcuni reperti la proprietà 'curativa' della DM02.
Vogliamo concludere con le parole di un archeologo, Licia Vlad Borrelli: “Gli studi sulle patine, le investigazioni sulla loro natura, i metodi per la loro protezione rappresentano oggi la frontiera più avanzata della scienza del restauro e la maggiore sfida per quanti operano in questo campo”.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-145 - Rocco Mazzeo, “Patine su manufatti metallici”, in “Le Patine, genesi significato, conservazione” Kermes Quaderni, Nardini Editore, Firenze 2005
Bib-TS-146 - Licia Vlad Borrelli, “Il punto di vista dell'archeologo” in “Le Patine, genesi significato, conservazione” Kermes Quaderni, Nardini Editore, Firenze 2005