Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà e metallurgia dello Stagno
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G07 - Proprietà metalli - Pag. ATS-G07.01
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
| Numero atomico | 50 |
| Massa atomica | 118.69 g.mol -1 |
| Elettronegativita' secondo Pauling | 1.8 |
| Densita' | 5.77g.cm-3 (alpha) and 7.3 g.cm-3 at 20°C (beta) |
| Punto di fusione | 232 °C |
| Punto di ebollizione | 2270 °C |
| Raggio di Vanderwaals | 0.162 nm |
| Raggio ionico | 0.112 nm (+2) ; 0.070 nm (+4) |
| Isotopi | 20 |
| Guscio elettronico | [ Kr ] 4d10 5s25p2 |
| Energia di prima ionizzazione | 708.4 kJ.mol -1 |
| Energia di seconda ionizzazione | 1411.4 kJ.mol -1 |
| Energia di terza ionizzazione | 2942.2 kJ.mol -1 |
| Energia di quarta ionizzazione | 3929.3 kJ.mol -1 |
| Scoperto da | Gli antichi |
Lo stagno è un metallo morbido, flessibile, bianco-argento. Lo stagno resiste alla corrosione di acqua distillata marina e di acqua di rubinetto dolce e può essere attaccato dagli acidi forti, alcali e sali acidi.
I principali stati di ossidazione sono +2 e +4. La coppia Sn2+ / Sn ha E0 = - 0,136 V mentre la coppia Sn4+ / Sn 2+ ha E0 = + 0,15 V. E' poco elettropositivo e viene facilmente attaccato dagli acidi e anche dalle basi. In questo modo lo stagno dimostra il suo carattere anfotero:
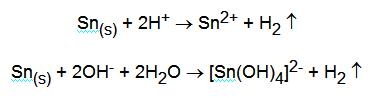
Con gli acidi ossidanti la reazione è del tipo:
![]()
L'acido nitrico concentrato non riesce a scioglierlo poiché lo trasforma in acido metastannico, insolubile:
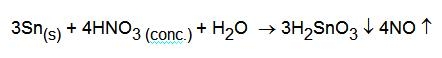
Questo non significa che lo stagno non viene ossidato dall'acido nitrico concentrato, ma che il prodotto di ossidazione non è solubile in acqua. La questione è importante in tutti i casi nei quali si ha la necessità di portare in soluzione lo stagno o una lega che lo contiene, ad esempio per farne l'analisi.
Le reazioni con acido solforico sono diverse a seconda che questo sia diluito o concentrato:
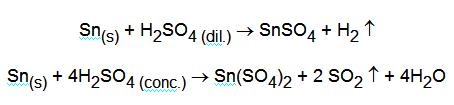
Nello stato di ossidazione inferiore esiste come catione libero a pH < 1 e precipita come Sn(OH)2, bianco, a pH 1,5 ¸ 2. L'idrossido può venire scritto anche come ossido idrato, SnO(aq). Questo si ridiscioglie a pH = 13 per formare lo ione stannito [Sn(OH)4]2-. Forma complessi con gli alogenuri e con lo ione ossalato. Tra i composti poco solubili è da ricordare SnS, bruno, che non ha carattere di solfoanidride ed è quindi insolubile in solfuro ammonico, mentre si scioglie in polisolfuro di ammonio per l'azione ossidante che questo ha sullo stagno(II) che diventa stagno(IV) secondo la reazione:
![]()
I composti di stagno (II) vengono ossidati all'aria e il metallo diventa stagno(IV).
Lo stagno(IV) è stabile come catione libero solo a pH molto acidi. A pH = 0,5 precipita Sn(OH)4, scritto anche come SnO2(aq.). Questo ossido ha carattere essenzialmente acido e si scioglie in ambiente basico:
![]()
Il sale poco solubile più importante è SnS2, una solfoanidride. Si complessa con cloruri, ossalati e tartrati.
Le reazioni analitiche coinvolgono lo stagno(II); va ricordato che al secondo gruppo lo stagno(II) viene ossidato secondo la reazione:
![]()
per cui prima di eseguire i saggi di conferma occorre ripassare a stagno(II) per riduzione operata ad esempio con ferro.
Le principali sono:
- con HgCl2: si ha la riduzione del mercurio(II) a Hg2Cl2 che precipita bianco e successivamente a Hg, nero; nel complesso si ottiene una colorazione più o meno grigia. Avvengono le reazioni:
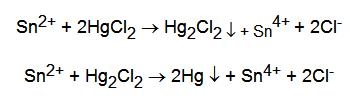
Fra gli usi più importanti di questo metallo vi è quello della banda stagnata (latta) usata nella fabbricazione dello scatolame. Altre applicazioni sono quelle nelle leghe per saldatura costituite da piombo e stagno, nella preparazione di metalli antifrizione, nei bronzi, nei fogli sottili per condensatori elettrici, nei peltri, ecc.
Lo stagno solido a temperature normali ha due forme allotropiche.
Sotto i 13,2 °C è stabile la forma allotropica alfa, detta stagno grigio, che ha una struttura cristallina cubica molto diversa dal silicio e dal germanio.
Sopra la temperatura limite di 13,2 °C invece è stabile la seconda forma allotropica, stagno beta, detto anche stagno bianco con una struttura cristallina tetragonale.
Stagno alfa: densità 5,769 g/cm-3; numero di coordinazione 4
Stagno beta: densità 7,265 g/cm-3; numero di coordinazione 6
Se raffreddato da solido, lo stagno bianco si riconverte lentamente nella forma allotropica alfa, un fenomeno noto come peste dello stagno che viene favorito da impurità di alluminio e zinco presenti nel metallo: per impedire questa trasformazione vengono aggiunte allo stagno puro piccole quantità di antimonio e bismuto.
Lo stagno è l'elemento con il maggior numero di isotopi stabili, dieci; questi comprendono tutti quelli con le masse atomiche fra 112 e 124, ad eccezione di 113, 121 e 123. Di questi, quelli più abbondanti sono 120Sn (almeno un terzo di tutto lo stagno), 118Sn e 116Sn, mentre quello meno abbondante è 115Sn.
Gli isotopi che possiedono numeri atomici pari non hanno spin nucleare, mentre quelli dispari hanno uno spin di +1/2.
Lo stagno, insieme ai suoi tre isotopi più comuni 115Sn, 117Sn e 119Sn, è tra gli elementi più facili da rilevare e analizzare mediante la spettroscopia NMR, e i suoi spostamenti chimici sono raffrontati rispetto allo SnMe4.
Si pensa che questo ampio numero di isotopi sia un risultato diretto dello stagno che possiede un numero atomico di 50, che nella fisica nucleare è un "numero magico". Ci sono 28 isotopi instabili aggiuntivi che sono noti, che abbracciano tutti quelli rimanenti con masse atomiche tra 99 e 137.
A parte lo 126Sn, che ha un'emivita di 230.000 anni, tutti gli isotopi radioattivi hanno un'emivita di meno di un anno. Lo 100Sn radioattivo è uno dei pochi nuclidi che possiedono un nucleo "doppiamente magico" e fu scoperto in tempi relativamente recenti, nel 1994.
Altri 30 isomeri metastabili sono stati caratterizzati per gli isotopi tra 111 e 131, il più stabile dei quali essendo lo 121mSn, con un'emivita di 43,9 anni.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-092 - L. Mugnani - Manuale pratico di fonderia - Milano, 1928
Bib-TS-093 - Dispense di Chimica - A.A. 1992/1993 - Facoltà di Ingegneria Edile / Architettura - Pavia