Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà e metallurgia del Rame
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G06 - Proprietà metalli - Pag. ATS-G06.02
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2011 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Ossidazione di rame metallico - PREPARAZIONE DI rame(ii) solfato - preparazione di ossido di rame(I)
Parte sperimentale I: preparazione solfato di rame(II) pentaidrato
Ossidazione di rame metallico - pREPARAZIONE DI rame(ii) solfato - preparazione di ossido di rame(I)
Si osserva la chimica acquosa del rame in alcuni dei suoi aspetti più importanti. Saranno condotte reazioni di ossido riduzione, acido - base e di complessamento che coinvolgono il rame nei suoi stati di ossidazione più comuni (I e II). Si hanno esempi pratici dei diversi tipi di reazione, dell’importanza dei potenziali di ossidazione, della stechiometria, dell’equilibrio mobile ecc..
Ossidazione per via chimica del rame metallico – preparazione del solfato di rame(II) pentaidrato.
Per portare in soluzione dei metalli (ed ottenere i loro composti) bisogna ossidarli. La maggior parte dei metalli, come zinco[1], ferro, alluminio, etc., è ossidata dallo ione H3O+ (H+) e quindi da acidi “normali” non ossidanti e si ha produzione di idrogeno molecolare.
2 M(s) + 2n H3O+ → 2 Mn+ + n H2(g) + 2n H2O
Il rame metallico, come altri metalli detti "nobili" oro, platino, palladio, etc., non è ossidato dallo ione H3O+. Nel caso dei metalli nobili bisogna usare un ossidante più energico dello ione H3O+ com'è, nel nostro caso, l'acido nitrico concentrato in ambiente fortemente acido.
In quest’esperienza il rame metallico viene ossidato con acido nitrico in presenza di acido solforico per ottenere solfato di rame secondo la reazione:
3Cu(s) + 2HNO3 + 3H2SO4 → 3CuSO4 + 2NO(g) + 4H2O (1)
L'acido solforico ha la doppia funzione di fornire gli ioni SO42- e di mantenere l'ambiente fortemente acido aumentando la capacità ossidante dell'acido nitrico. Dalla reazione si svolgono dei vapori rosso-bruni di biossido di azoto. L’ossido di azoto (NO), infatti, si ossida all'aria per dare biossido di azoto (NO2). Il biossido di azoto, un gas di colore rosso-bruno, è in equilibrio con la sua forma dimera N2O4 (tetraossido di diazoto, ipoazotide), incolore:
2NO(g) + O2(g) → 2NO2(g) (2)
2NO2(g) → N2O4(g) (3)
[1] Lo zinco è usato in un successivo momento di quest’esperienza per ridurre lo ione Cu2+ a Cu metallico. Si deve evitare di procedere in un ambiente acido (ioni H3O+) perché lo zinco sarebbe ossidato dagli ioni idronio.
In soluzione acquosa esistono composti di rame(I) solo sotto forma di complessi, si possono anche ottenere composti di rame(I) come prodotti insolubili (sali e ossido).
Infatti, lo ione Cu+ (Rame(I)), in acqua, non è stabile in quanto esso dismuta (o disproporziona) a Cu2+ e Cu secondo la reazione:
2Cu+ → Cu2+ + Cu (4)
La costante dell’equilibrio di
disproporzionamento (4) è circa 106,
![]() (Approfondimento II)
così, alle concentrazioni dell’
esperimento, il rame in soluzione è praticamente solo rame(II).
(Approfondimento II)
così, alle concentrazioni dell’
esperimento, il rame in soluzione è praticamente solo rame(II).
Per ottenere composti di rame(I), in acqua, si deve spostare la reazione verso sinistra sottraendo opportunamente all’ equilibrio (4) ioni Cu+.
Un modo di sottrarre rame(I) all’equilibrio è quello di far si che esso precipiti come un composto poco solubile (CuI, CuCl, CuCN, Cu2O), un altro è di far sì che esso formi dei complessi molto stabili (per esempio Cu(CN)2- (dicianocuprato(I)) , CuCl2- (diclorocuprato(I))).
In
sintesi, per preparare un composto di rame(I) bisogna avere un opportuno agente
complessante o precipitante in presenza di rame(II) e rame metallico che sono in
rapporto stechiometrico.
Nel nostro caso prepareremo cloruro rameoso dal solfato rameico passando
attraverso la formazione di intermedia di Cu(OH)2
(reazione 5)
e di CuCl2 (dissoluzione con HCl,
reazione 6)
![]() (Parte sperimentale II).
(Parte sperimentale II).
Cu2+ + 2OH- → Cu(OH)2 (s) (5)
Cu(OH)2(s) + 2HCl → Cu2+ + 2Cl- + 2H2O (6)
Quest'ultimo sarà fatto reagire con rame metallico (a sua volta prodotto per riduzione di un’altra porzione di Cu2+ con Zn).
Cu2+ + Zn(s) → Zn2+ + Cu(s) (7)
in un ambiente ricco di ioni Cl-, generando CuCl2- (reazione 8) e CuCl(s) (reazione 9).
Cu2+ + Cu(s) + 4Cl- → 2CuCl2- (8)
CuCl2- → CuCl(s) + Cl- (9)
In ambiente moderatamente basico si
formerà poi Cu2O.
![]() (parte
sperimentale III).
(parte
sperimentale III).
2 CuCl(s) + 2OH- → Cu2O(s) + 2 Cl- (10)
Acido Solforico concentrato. E’ un forte disidratante, un ossidante ed un acido forte; queste proprietà lo rendono estremamente corrosivo per la pelle e per gli altri tessuti del corpo (occhi, mucose etc.). La dissoluzione in acqua è fortemente esotermica.
Acido Nitrico concentrato.
Devono essere sempre maneggiato sotto cappa. Usare le opportune protezioni (guanti ed occhiali). Non produrre schizzi; nella diluizione bisogna sempre aggiungere molto lentamente l’ acido, agitando, ad una quantità opportuna di acqua.
Contatto con la pelle: ottenere al più presto aiuto medico, lavare per almeno 15 min con abbondante acqua e sapone, rimuovere i vestiti contaminati, non riusare scarpe contaminate.
Contatto con gli occhi: ottenere al più presto aiuto medico, NON strofinare o chiudere gli occhi. Lavare gli occhi per almeno 30 min con abbondante acqua alla fontanella.
Solfato di rame(II). Tossico, moderatamente pericoloso.
Non toccare con le mani.
Acetone. Tossico, moderatamente pericoloso. Altamente infiammabile.
Non inalare direttamente, non toccare con le mani. Tenere lontano da fiamme libere.
I gas prodotti NO, NO2 N2O4 sono tossici od altamente tossici.
Usare l’acido nitrico (che li produce) solo sotto cappa.
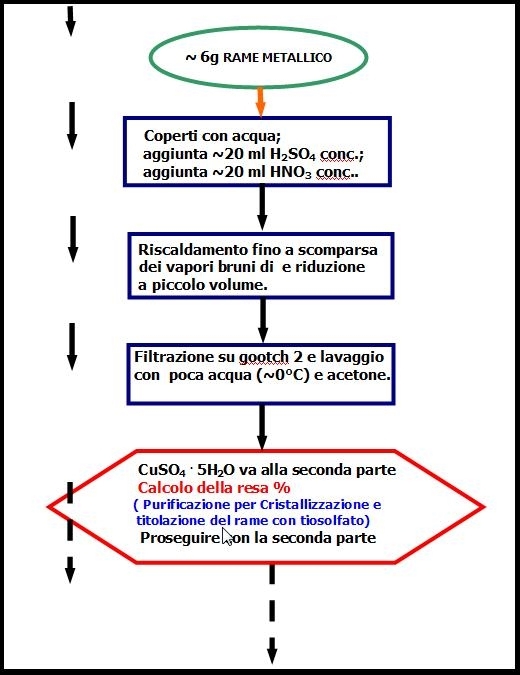
Circa 6 g di Cu metallico in trucioli, pesati accuratamente, sono posti in un bicchiere da 150-250 cm3. Successivamente (sotto cappa) coprirli con poca acqua (20-30 cm3 dovrebbe bastare) e aggiungere (procedere con cautela) ~20cm3 di acido solforico concentrato. Aggiungere a piccole porzioni e lentamente ~20 cm3 di acido nitrico concentrato. Alla fine riscaldare la miscela dapprima lentamente e poi all’ebollizione fino a completa dissoluzione del rame e completa scomparsa dei vapori rosso bruni di NO2 (equazioni (1), (2) e (3)).
Tenendo sotto controllo il riscaldamento in modo da non produrre schizzi, concentrare la soluzione fino a piccolo volume e poi lasciare raffreddare lentamente. Filtrare su setto poroso (gooch 2) i cristalli blu che si sono formati, lavarli prima con poche gocce d’acqua a ~ 0 °C e poi con acetone. Asciugarli a freddo, pesare e calcolare la resa, ricordando che il CuSO4 cristallizza come pentaidrato.
Anche se non è necessario per questa esperienza, si purifica il rame per cristallizzazione e si verifica il numero di molecole d’acqua per titolazione iodometrica con sodio tiosolfato (vedi istruzioni aggiuntive).
Idrossido di sodio solido e soluzione. Corrosivi.
Evitare contatto con mani occhi ed occhi.
In caso di contatto lavare con abbondante acqua per almeno 15 min.
Acido cloridrico concentrato. Acido forte. Corrosivo. Libera vapori corrosivi di HCl.
Deve essere sempre maneggiato sotto cappa. Usare le opportune protezioni (guanti ed occhiali). Non produrre schizzi; nella diluizione bisogna sempre aggiungere molto lentamente l’ acido, agitando, ad una quantità opportuna di acqua. Non inalare i vapori.
Contatto con la pelle: lavare per almeno 15 minuti con abbondante acqua, rimuovere i vestiti contaminati, non riusare scarpe contaminate.
Contatto con gli occhi: ottenere al più presto aiuto medico, NON strofinare o chiudere gli occhi. Lavare gli occhi per almeno 30 min con abbondante acqua alla fontanella.
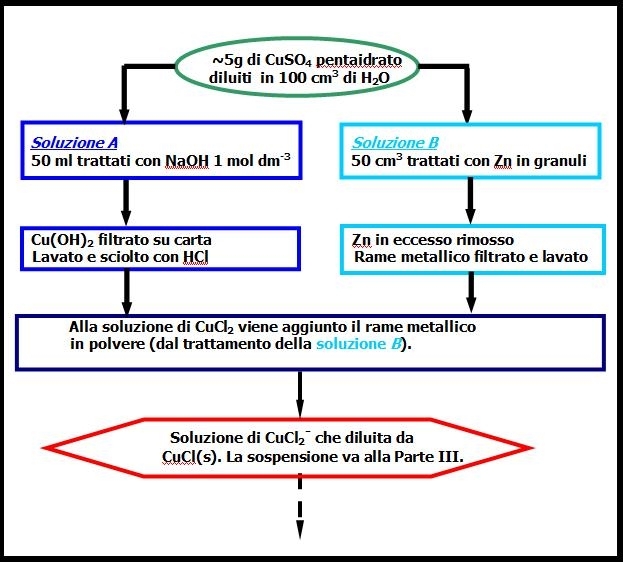
Circa 5g di CuSO4 . 5H2O, pesati accuratamente in un matraccio tarato da 100.0 cm3, sono sciolti in H2O e la soluzione viene portata a volume (100.0 cm3). La soluzione viene poi, divisa in due parti uguali A e B con l’ausilio della pipetta tarata. (Attenzione i bicchieri non sono adatti per la misura accurata di volumi; usare la pipetta).
La soluzione A viene trattata con NaOH 1.0 mol dm-3, goccia a goccia, sotto agitazione, fino a completa precipitazione di Cu(OH)2 azzurro (eq (5)). Si filtra su carta e si lava abbondantemente con acqua calda fino a reazione neutra (cartina indicatrice) e scomparsa degli ioni solfato.
(Si controlla la presenza di solfati nel seguente modo: si pongono 1 o 2 ml di soluzione filtrata in una provetta e si aggiunge qualche goccia di soluzione di BaCl2 ~0.5 mol dm-3. In assenza di ioni solfato la soluzione rimane limpida; in presenza di ioni solfato si osserva la formazione di BaSO4, insolubile, che rende torbida la soluzione).
Il precipitato ancora umido viene disciolto con la minima quantità possibile di HCl 1 mol dm-3 Si ottiene una soluzione di CuCl2 verde azzurra (eq. (6)). Si allontana l’ inevitabile eccesso di HCl aggiungendo qualche goccia di NaOH fino ad iniziare la precipitazione di Cu(OH)2 che poi viene disciolto nuovamente con qualche goccia di HCl. (Non usare la cartina indicatrice – la soluzione non deve essere neutra. Una soluzione di rame(II) è debolmente acida)
La soluzione B è trattata con un eccesso di Zn granulare (~ 3 o 4 volte il necessario stechiometrico) sotto agitazione. Si ottiene Cu metallico sotto forma di polvere marrone scuro e la completa decolorazione della soluzione (eq. (7)). Il Cu è filtrato su carta, i granuli di zinco che non hanno reagito sono rimossi con l’ausilio della spatola. Il solido filtrato viene lavato prima con HCl diluito ( 1.0 mol dm-3) e poi con acqua.
Il rame così ottenuto è versato nel bicchiere contenente la soluzione di CuCl2, aiutandosi con un piccolo getto d’acqua. Si lascia agitare per circa ½ ora fino ad ottenere la completa scomparsa di Cu e la formazione di una soluzione di CuCl2- (eq. (8)). Nel caso che la reazione sia troppo lenta, riscaldare la soluzione a ~50 °C e aggiungere NaCl solido. Concentrare la soluzione a 50 ml e versarla in circa 100 ml di H2O ottenendo un precipitato bianco di CuCl e una soluzione leggermente azzurra (eq. (9)).
Sodio tetraborato. Moderatamente tossico, può causare irritazioni.
Evitare contatto con mani ed occhi.
In caso di contatto lavare con abbondante acqua per almeno 15 minuti.
Altri reattivi o prodotti. Moderatamente tossici.
Non devono essere toccati con le mani, evitare il contatto con gli occhi.
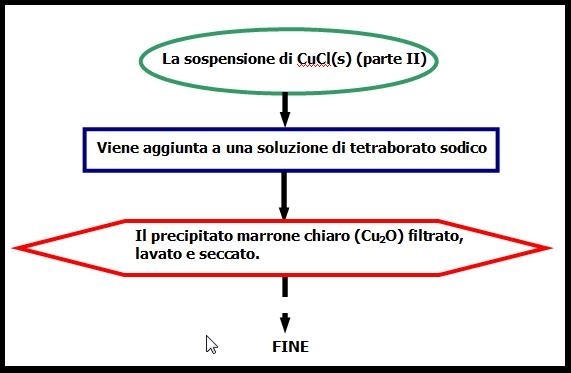
Si aggiunge la sospensione precedentemente ottenuta ad una soluzione acquosa bollente di Na2B4O7 .10H2O. (10 g in 200 cm3 di acqua). Controllare che la miscela sia sempre basica (pH 8 – 10), aggiungere eventualmente dell’altra borace (tetraborato sodico) solida. Lasciare bollire per circa 20 min. e raffreddare (eq. (10)) Lasciare depositare il precipitato marrone, separare le acque madri per filtrazione su setto poroso (G3) , lavare con H2O e poi con acetone.
Si può evitare di intasare il filtro ponendo un dischetto di carta per filtrazione di dimensioni adatte sul setto poroso.
Parte (o tutta) della capacità ossidante degli acidi deriva dalla ione H+.
Dall’espressione del potenziale ossido riduttivo relativo alla semi - reazione dello ione H+ (H3O+):
2H+ + 2e → H2(g)
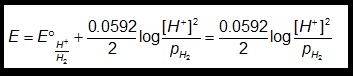
si ottiene (se l’H2 si libera all’atmosfera p(H2) =1.00 atm )
E = -0.0592 pH
Una soluzione di H+ 1.0 mol dm -3 (pH = 0, E=0.0 V) è in grado di comportarsi da ossidante solo rispetto a quelle coppie ossido - riduttive che hanno potenziali più piccoli del suo cioè minori di zero (in modo quantitativo se il potenziale è inferiore a –0.300 V; a pH più alti H+ è meno ossidante).
I metalli “normali” che hanno potenziale normale ossido riduttivo negativo come zinco e alluminio:
Zn2+ + 2e → Zn E° = -0.763 V
Al3+ + 3e → Al E° = -1.662 V
possono essere ossidati dallo ione H+ di acidi minerali non ossidanti. Alcuni di questi metalli, per esempio quelli del gruppo I, del gruppo II ed i lantanidi, sono così riducenti che vengono ossidati anche dall’acqua. In alcuni casi, la reazione di ossidazione è così esotermica che l’idrogeno prodotto è così caldo che prende fuoco all’aria.
I metalli “nobili” invece hanno un potenziale ossido - riduttivo > 0:
Cu2+ + 2e → Cu E°=0.314 V
Ag+ + e → Ag E°=0.800 V
e richiedono un ossidante più energico di H+ quale può essere l’acido nitrico in ambiente acido.
Dalla espressione del potenziale della semireazione relativa alla riduzione dell' acido nitrico:
4H+ + NO3- + 3e → NO(g) + 2H2O
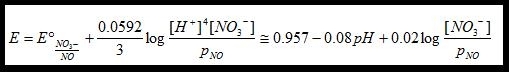
si osserva che il potenziale aumenta col diminuire del pH. In altri termini all'aumentare dell'acidità il potere ossidante dell'acido nitrico aumenta.
Nella reazione di dismutazione uno ione Cu+ si comporta da ossidante rispetto ad un altro ione rameoso (che rispettivamente si comporta da riducente) perché il potenziale normale della coppia:
Cu+ + e → Cu(s)
è più grande del potenziale della coppia red-ox:
Cu2+ + e → Cu+
Così la reazione complessiva:
Cu+ + Cu+ → Cu(s) + Cu2+
può procedere (e procede) spontaneamente da sinistra a destra anziché in senso inverso (dismutazione favorita rispetto al comproporzionamento).
Dai valori di E° delle due semireazioni:
Cu+ + e → Cu E° = 0.52V
Cu2+ + e → Cu+ E° = 0.15V
Si può ricavare la costante di equilibrio (Kdis) della reazione di dismutazione:
2Cu+ → Cu + Cu2+
Infatti, eguagliando i potenziali delle due semireazioni (che si verifica all’equilibrio – quando le concentrazioni sono d’equilibrio)

Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-014 - Aldigheri P. Le leghe bronzee e le loro applicazioni, Università di Trento, 2003
Bib-TS-076 - Mark Pollard and Carl Heron, Archaeological Chemistry. The Royal Society of Chemistry (1996)
Bib-TS-079 - Mauro Matteini e Arcangelo Moles, La Chimica del Restauro. Nardini Editore (1989)
Bib-TS-080 - J.B.Lambert Traces of the Past. Helix Book (1997)