Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà e metallurgia del Piombo
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G05 - Proprietà metalli - Pag. ATS-G05.01
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
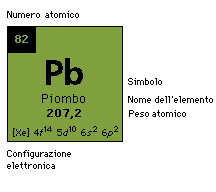
| Numero atomico | 82 |
| Massa atomica | 207.2 g.mol -1 |
| Elettronegtivita' secondo Pauling | 1.8 |
| Densita' | 11.34 g.cm-3 at 20°C |
| Punto di fusione | 327 °C |
| Punto di ebollizione | 1755 °C |
| Raggio di Vanderwaals | 0.154 nm |
| Raggio ionico | 0.132 nm (+2) ; 0.084 nm (+4) |
| Isotopi | 13 |
| Guscio elettronico | [ Xe ] 4f14 5d10 6s2 6p2 |
| Energia di prima ionizzazione | 715.4 kJ.mol -1 |
| Energia di seconda ionizzazione | 1450.0 kJ.mol -1 |
| Energia di terza ionizzazione | 3080.7 kJ.mol -1 |
| Energia di quarta ionizzazione | 4082.3 kJ.mol -1 |
| Energia di quinta ionizzazione | 6608 kJ.mol -1 |
| Scoperto da | Gli antichi |
Il piombo è un brillante metallo di colore bianco-bluastro. È molto morbido, altamente malleabile, duttile, e un conduttore di elettricità relativamente povero . È molto resistente alla corrosione ma si appanna a seguito di esposizione ad aria.
Presenta i numeri di ossidazione +2 e +4. Per la coppia Pb2+/Pb si ha E0 = - 0,126 V, mentre per la coppia Pb4+/Pb2+ il potenziale standard vale E0 = + 1,69 V. Nonostante il potenziale della coppia Pb2+ / Pb sia negativo, il piombo metallico viene scarsamente attaccato dagli acidi ossidanti, perchè esso forma spesso sali poco solubili che generano sulla superficie del metallo un leggero strato protettivo. Il metallo viene attaccato dall'acido nitrico con reazioni del tipo:
![]()
Attaccandolo con acido solforico non molto concentrato si ha l'ossidazione del metallo e la formazione di PbSO4, bianco e insolubile; con acido solforico concentrato, invece si forma Pb(HSO4)2, solubile:
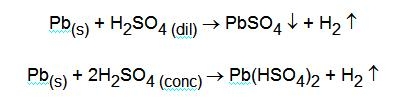
Nello stato di ossidazione inferiore precipita a pH = 7 come Pb(OH)2 che si ridiscioglie a pH = 13 per formazione di complessi piombosi.
La maggior parte dei sali è insolubile o poco solubile: PbSO4, PbCl2, PbBr2, PbI2, PbCrO4, PbS. Non forma molti complessi. I più stabili sono quelli con gli alogenuri.
I complessi con lo ione acetato sono del tipo [Pb(CH3COO)]+ e [Pb(CH3COO)4]2- e sono molto importanti ai fini analitici. La loro formazione viene infatti sfruttata per portare in soluzione composti poco solubili come ad esempio PbSO4.
Nello stato di ossidazione +4 non esiste come ione libero in soluzione. Il catione, infatti, è molto acido per cui in acqua sarà quasi completamente idrolizzato secondo reazioni del tipo:
![]()
nelle quali l'equilibrio è quasi del tutto spostato a destra. I composti più stabili risultano il PbO2 e i complessi.
Il metallo viene attaccato dall'acido nitrico e solforico concentrati, nonché dall'acido cloridrico e iodidrico, sempre comunque molto lentamente.
Il piombo si scioglie anche in soluzioni di idrossidi alcalini a caldo, con formazione dello ione complesso piombito:
![]()
Le reazioni analitiche principali riguardano lo ione piomboso, e sono:
- con H2SO4 o comunque con SO2-4 : precipita PbSO4, bianco, insolubile in quasi tutti i reattivi non complessanti;
- con I- : precipita PbI2, giallo, che può ridisciogliersi in eccesso di ioni I- per formazione di [PbI4]2- ;
- con CrO2-4 in ambiente non troppo acido: precipita PbCrO4, giallo;
- con H2S: precipita PbS, nero, che è uno dei solfossidi del secondo gruppo analitico.
Un composto molto noto del piombo è il piombotetraetile, usato come additivo antidetonante nella benzina, che si prepara facendo reagire una lega sodio-piombo con cloruro di etile:
![]()
Un altro composto di largo impiego è il minio, che ha formula Pb3O4 e che è in sostanza un ossido misto: 2PbO . PbO2. E' di colore arancione e viene usato come ricoprente antiruggine per i metalli. Il suo impiego maggiore consiste nella fabbricazione di batterie di accumulatori.
Il piombo trova altre importanti applicazioni nella fabbricazione di pigmenti, di tubazioni, come rivestimento per speciali apparecchiature per l'industria chimica e per la fabbricazione di canne d'organo.
Tubazioni in piombo che portano le insegne degli
imperatori romani, usate per gli scarichi dei bagni, sono ancora in servizio. Le
leghe includono peltro e saldatura.
Il piombo si presenta naturalmente nell'ambiente. Tuttavia, la maggior parte del piombo che si trova in ambiente e' prodotto da attività umane. Grazie all'applicazione di piombo nella benzina si e' stato formato un ciclo artificiale del piombo. Nel motori delle automobili viene bruciato piombo, che porta all'inizio della formazione di sali (cloro, bromo, ossidi).
Questi sali di piombo entrano nell'ambiente attraverso gli scarichi delle
automobili. Le particelle piu' grandi finiscono immediatamente sul terreno o
nell'acqua superficiale inquinandola, mentre le particelle più piccole
attraverseranno lunghe distanze attraverso l'aria e rimarranno
nell'atmosfera. Una parte di questo piombo ricadrà sulla terra sottoforma di
pioggia. Questo ciclo del piombo causato dalla produzione umana è molto più
esteso del ciclo naturale del piombo. Ciò ha reso l'inquinamento da piombo
un problema mondiale.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-092 - L. Mugnani - Manuale pratico di fonderia - Milano, 1928
Bib-TS-093 - Dispense di Chimica - A.A. 1992/1993 - Facoltà di Ingegneria Edile / Architettura - Pavia