Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Proprietà e metallurgia del Ferro
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-G03 - Proprietà metalli - Pag. ATS-G03.01
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2008 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Elemento chimico di simbolo Fe, di peso atomico 55,84 ; numero atomico 26.
Il ferro metallico chimicamente puro è un metallo di colore bianco e lucente.
Fonde a ca. 1540 °C e bolle a 3070 °C; il suo peso specifico è di 7,87 g/cm3.
Il ferro è polimorfo: a temperatura ambiente e fino a 769 °C è stabile la forma α, ferromagnetica, con un reticolo cristallino cubico centrato ; tra 769 e 910 °C è stabile la forma β, che ha lo stesso reticolo ma non è più ferromagnetica; tra 910 e 1390 °C è stabile la forma γ con reticolo cubico a facce centrate e tra 1390 °C e il punto di fusione è stabile la forma δ, con reticolo simile a quello della forma α.
Inoltre il ferro ha la proprietà di magnetizzarsi quando è sottoposto ad un campo magnetico.

Il ferro ha i numeri di ossidazione +2 e +3.
Il potenziale della coppia Fe2+ / Fe vale E0 = - 0,44 V mentre quello della coppia Fe3+/ Fe2+ è positivo e vale E0 = + 0,77 V.
E' un elemento elettropositivo e si ossida rapidamente all'aria umida formando un ossido idrato che non è in grado di proteggere la superficie del metallo (ruggine).
Si scioglie facilmente negli acidi diluiti non ossidanti sviluppando idrogeno e ossidandosi a ferro (II) se l'attacco viene condotto in assenza di aria:
Fe(s) + 2H+ ® 3 Fe2+ + H2
Dagli acidi ossidanti diluiti viene invece ossidato a ferro (III):
Fe(s) + 4H+ + NO-3 ® (a caldo) ® Fe3+ + NO + 2H2O
L'acido nitrico concentrato lo passiva, per cui la reazione non procede.
Nello stato di ossidazione +2 esiste libero in soluzione ed è di color verde pallido. Inizia a precipitare intorno a pH = 8 come Fe(OH)2, ma questo idrossido non fa parte del terzo gruppo analitico. Questo sale si ossida rapidamente all'aria assumendo colorazioni sempre più scure per formazioni di idrossidi misti di ferro (II) e ferro (III) diventando alla fine Fe(OH)3, rosso mattone.
E' un elemento di transizione che forma molti complessi, soprattutto con ammoniaca, tartrati, ossalati e cianuri, che però resistono poco all'aria per l'ossidazione a ferro (II) dell'atomo centrale.
Tra i composti ferrosi poco solubili, da ricordare: FeCO3, Fe3(PO4)2, FeS.
Lo ione ferrico è di gran lunga lo stato più stabile per questo metallo. In acqua esiste libero solo in ambiente reso nettamente acido con HClO4, perché con altri acidi diversi è presente in forma più o meno complessata, come ad esempio [FeCl]2+ o [FeCl2]+. A pH = 2 precipita come Fe(OH)3 che si ridiscioglie negli acidi. Quando viene calcinato forma l'ossido anidro Fe2O3, rosso-bruno, insolubile sia negli acidi che nelle basi.
Forma complessi con quasi tutti i leganti conosciuti; questi complessi normalmente sono colorati.
Pochi invece i composti poco solubili: il già citato Fe(OH)3, Fe2S3.
In realtà per trattamento di soluzioni acide di ferro (II) e ferro (III) non precipitano i due solfuri, ma solo FeS, in quanto lo ione ferrico viene semplicemente ridotto a ione ferroso.
Per ottenere i due solfuri è necessario operare in ambiente neutro e usare (NH4)2S.
Dei due cationi che il ferro può dare, quello analiticamente più interessante è il più ossidato. Le sue reazioni di maggior interesse sono:
- con OH- : precipita l'idrossido, rosso mattone, gelatinoso;
- con CNS- : precipita Fe(CNS)3, rosso sangue;
- con K4[Fe(CN)6]: si ha un precipitato blu intenso di KFe[Fe(CN)6].
L'uso di gran lunga più diffuso del ferro è nell'industria siderurgica. Viene usato principalmente per la produzione degli acciai (leghe a basso tenore di carbonio) e delle ghise (leghe ad elevato tenore di carbonio).
Complessi del ferro (II) con lo ione cianuro, detti ferrocianuri sono usati per la preparazione di pigmenti minerali come il Blu di Prussia. I complessi del ferro (III) detti ferricianuri, si usano come ossidanti e come reagenti analitici.
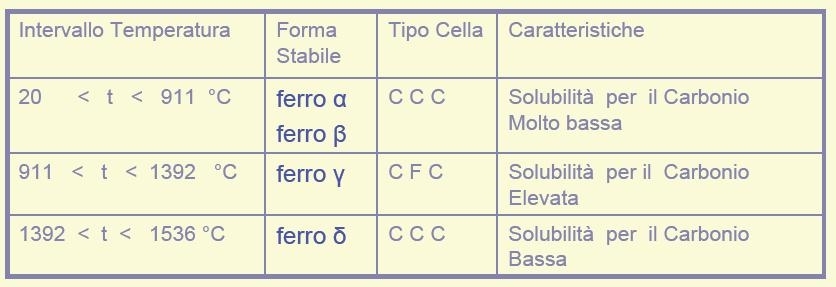
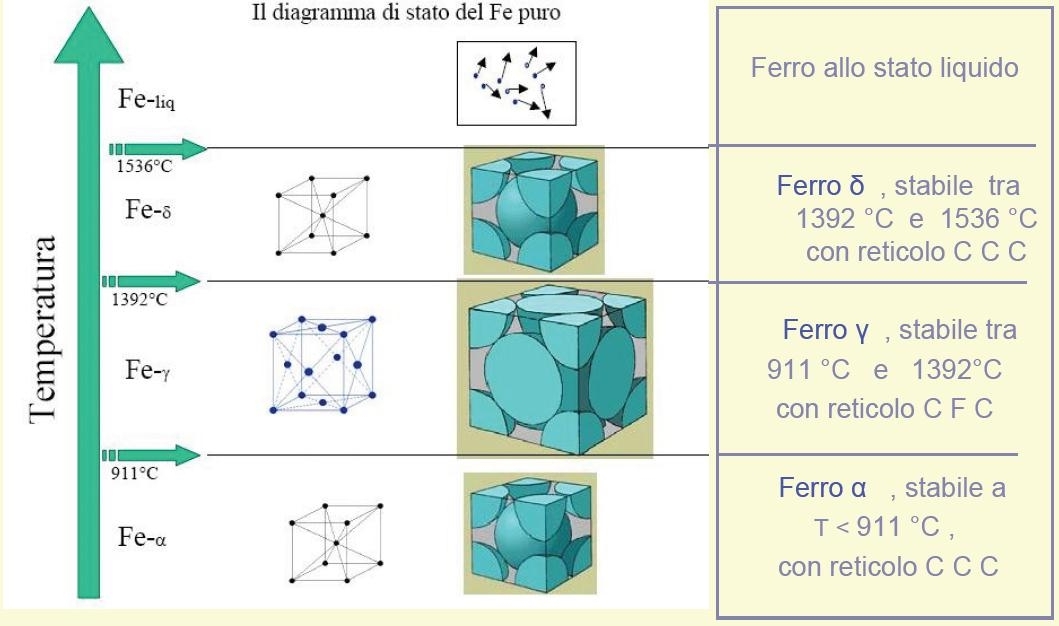
Il ferro puro, al variare della temperatura, si presenta in quattro forme allotropiche, diverse per la disposizione degli atomi nel reticolo cristallino :
ferro α, stabile a temperature inferiori a 769 °C, con reticolo C C C;
ferro β, stabile tra 769 °C e 911 °C , con reticolo C C C;
ferro γ, stabile tra 911 °Ce 1392 °C, con reticolo C F C;
ferro δ, stabile a temperature da 1392 °C a 1536 °C con reticolo C C C.
La capacità del ferro di accogliere nel suo reticolo atomi di carbonio rende possibile la fabbricazione delle cosiddette leghe ferrose ossia della ghisa e dell’acciaio, note fin dall’antichità.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-010 - M. Cavallini, F. Iacoviello - Materiali Metallici - Francesco Ciolfi Editore, via E. De Nicola, Cassino
Bib-TS-011 - W. Nicodemi - Metallurgia - Masson, Milano
Bib-TS-012 - A. Cigada - Struttura e proprietà dei materiali metallici - Città Studi, Milano
Bib-TS-013 - Lucidi del corso di "Metallurgia" sono disponibili in formato pdf all’indirizzo: http://www.metallurgia.unicas.it
Bib-TS-092 - L. Mugnani - Manuale pratico di fonderia - Milano, 1928
Bib-TS-093 - Dispense di Chimica - A.A. 1992/1993 - Facoltà di Ingegneria Edile / Architettura - Pavia