Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Analisi chimiche per materiali e metalli
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-F03 - Chimica - Pag. ATS-F03.10
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Principio di funzionamento: tramite la temperatura si può misurare la massa del campione; il procedimento pratico è sottoporre il campione ad un programma di riscaldamento in atmosfera controllata.
Riscaldamento = trasformazioni chimico-fisiche = assorbimento/cessione di energia = aumento/diminuzione di peso
Specie chimiche diverse reagiscono trasformandosi a temperature differenti ma caratteristiche (comunque tra i 900-1000°C, pur essendo la capacità del forno a 1500°C). Per questo motivo si possono riconoscere le specie chimiche presenti nel campione, anche se spesso si hanno delle aspettative.
Le trasformazioni che i campioni subiscono più spesso si volatilizzano in forma gassosa:
- Perdita di H2O (gesso e ossalato di calcio) (Calce: CaSO4 . H2O, formando ossalato di calcio); avviene praticamente sempre a 100°C
- Perdita di CO e CO2 (ossalato di calcio, calcite, magnesite, idromagnesite) (Carbonato di calcio: CaCO3 → CaO + CO2)
E’ dunque una tecnica QUALITATIVA, ma ancora migliore come tecnica QUANTITATIVA : infatti mi dà una stima dell’elemento che si volatilizza.
SCHEMA DELLO STRUMENTO:
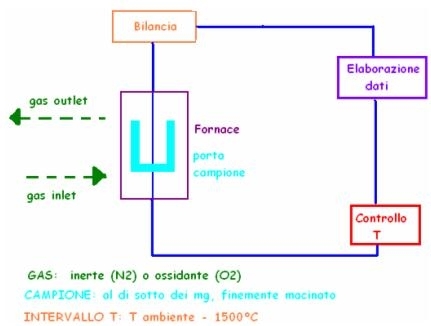
Il campione deve essere macinato per rendere più chiara la temperatura superficiale specifica dell’elemento.
Nella FORNACE di platino (resistente ad alte temperature) c’è un gas che esce e entra; può essere N2 che è inerte e serve solo a portare via i gas.
Oppure si usa O che è un ossido e si può legare ai carboni: in questo modo si formano sì nuovi prodotti, ma che alla fine servono a calcolare il peso dell’elemento.
La fornace è collegata ad una BILANCIA molto sensibile, il tutto collegato ad un ELABORATORE DI DATI che monitora peso e temperatura.
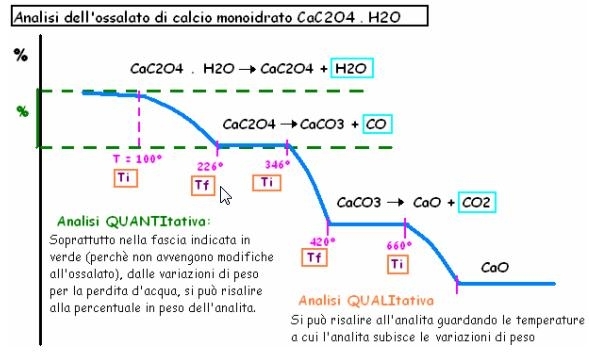
Questo crea un grafico, detto TERMOGRAMMA, di cui facciamo un esempio.
ANALISI QUALITATIVA: si effettua analizzando i flessi del termogramma e poi confrontandoli con dei libri di riferimento per capire che analita sia. Bisogna interpretare bene i salti, ma purtroppo spesso gli analiti sono molteplici e si confondono e sovrappongono nel termogramma finale.

ANALISI QUANTITATIVA: A 100°C l’ossalato perde H2O; perciò ad esempio, se prima il peso era 100%, ora è diminuito del 10%, giungendo così a 90%. Conoscendo il peso totale (es: 100%= 10 mg), grazie alle moli si può calcolare la concentrazione. Nel caso della calce, la quantità di H2O sarà uguale a quella della calce stessa perché stanno in rapporto 1:1 (la sua formula infatti è CaC2O4 . H2O). Ora che sappiamo la concentrazione in moli, fai il processo inverso dividendo le moli per la concentrazione del campione: (N°moli X peso molecolare CaC2O4 = peso) 0,5 mmol . 128 mg / mmol = 64 mg. Se si calcolano gli altri salti di massa, si dovrebbero ottenere gli stessi risultati perché si calcola in 2 modi diversi la stessa reazione (in genere l’analisi si fa su un solo salto più accentuato e caratteristico).
Vantaggi:
- Velocità (un’analisi si completa facilmente in un’ora).
- Sensibilità (le misure in peso sono tra le più precise).
- Versatilità.
- Minima quantità e manipolazione del campione (poco campione per aver meno analiti presenti).
Svantaggi:
- Scarsa selettività.
- Necessità di riferimenti standard (l’ossalato di calcio viene usato per tarare la bilancia).
- Analisi strettamente quantitativa.
Manufatti indagabili:
- Malte (contenuto di legante come calcite, magnesite, dolomite). Hanno salti ben definiti.
- Stucchi (contenuto dicalcite e gesso). Hanno grafici facilmente interpretabili e reagiscono con temperature molto alte.
- Prodotti di degrado (contenuto di gesso).
- Pigmenti.
- Prodotti di restauro (polimeri).
Precisazione: Se dobbiamo calcolare la quantità di calcite delle malte, bisogna anche calcolare anche il gesso perché la calcite si trasforma in gesso; quindi bisogna fare un calcolo diretto e anche uno diretto.
Gruppo di tecniche:
-
termogravimetria TG- analisi termica differenziata DTA
- clorimetria differenziale a scansione DSC
una proprietà fisica di una sostanza o di un suo prodotto di reazione viene misurata in funzione della temperatura programmata. Si ottengono termogrammi che riportano il calore in funzione del tempo o della temperatura.
Caratteristiche tecniche termo analitiche:
* distruttive ma si possono applicare su minime quantità di materiale;
* informazioni sia su materiali inorganici sia organici, cristallini o amorfi;
* campione in genere non necessita di nessun pretrattamento;
* tempi di analisi brevi, circa 15 minuti;
* è spesso possibile ottenere informazioni piu numerose ripetendo le analisi in atmosfere diverse;
* se è possibile studiare il reperto con più tecniche termo analitiche il quadro delle informazioni ottenibili è più completo.
* risultati migliori si ottengono se le informazioni fornite da termo analisi sono integrate con quelle derivanti da altre tecniche analitiche strutturali.
Le applicazioni di analisi termica sono molteplici:
- chiarificazione di quesiti irrisolti proposti da studiosi di archeologia;
- eseguire analisi qualitative o quantitative;
- evidenziare antichi metodi di lavorazione dei manufatti;
- accertare con quali materiali venivano anticamente ottenuti manufatti;
- determinare valore alcuni parametri fisici relativi a trattamenti cui è stato sottoposto materiale durante la lavorazione;
- costruire scale archeometriche per determinati manufatti.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Dispense tratte da: http://doc.studenti.it/download/skip/chimica-ambiente-beni-culturali_1.html (nel 2012, ora il sito non è più esistente)
Bib-TS-086 - M. Matteini, M. Moles, la Chimica nel restauro, Nardini editore, Firenze
7 - M. Matteini, M. Moles, Scienza e restauro, Nardini editore, FirenzeBib-TS-088 - L. Appolonia, S. Volpin, Le analisi di laboratorio applicate ai beni artistici policromi, casa editrice il Prato, Padova