Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Analisi chimiche per materiali e metalli
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-F03 - Chimica - Pag. ATS-F03.08
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Le tecniche spettroscopiche si basano sull’esame dello spettro caratteristico di ogni elemento, sfruttando l’interazione di una radiazione elettro-magnetica con la materia. Si distinguono in spettrometria di emissione, di assorbimento e di diffrazione.
Lo spettrofotometro è un apparecchio costituito essenzialmente da una sorgente di radiazioni (ultraviolette, visibili o infrarosse), da un monocromatore a prisma (o reticolo) e da un rilevatore fotoelettrico di radiazioni. In particolare vengono usate lunghezze d’onda dell’infra-rosso perché molto utili ad individuare i composti.
Le radiazioni, a causa della loro bassa energia, non promuovono elettroni a livelli superiori, ma fanno solamente vibrare gli atomi all’interno delle molecole. A seconda degli atomi (e della qualità e della quantità dei legami) si ha un assorbimento di frequenze radianti infrarossi diverse e, quindi, un diverso spettro. Lo spettro IR nei confronti di una sostanza ha un ottimo valore diagnostico, superiore ad altri dati, come il punto di fusione, la densità e l’indice di rifrazione.
Le tecniche spettroscopiche si dividono in:
- - Spettroscopie molecolari (UV-vis, IR e Raman) – tecnica qualitativa e quantitativa.
- - Spettroscopie atomiche (assorbimento ed emissione atomiche) – tecnica qualitativa.
PRINCIPIO DI FUNZIONAMENTO- Lo spettro completo è formato da 3 tipi di onde: ultra-violetto (200-400nm), visibile (400-700nm) e infra-rossi (700-4000 nm). Se faccio passare una quantità di onde (di tutti questi tipi) nel campione, le onde si infrangeranno contro la struttura interna del campione: in questo modo, parte delle onde verrà riflessa, parte assorbita, parte filtrerà dall’altra parte, o indenne o un po’ diminuita d’intensità.
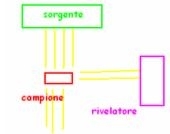
LO STRUMENTO: LO SPETTROFOTOMETRO- E’ lo strumento che permette di registrare le differenze di radiazione tra quella emessa in origine e quella filtrata. Esistono di due tipi, a raggio singolo e a doppio raggio, ma quest’ultimo è molto più usato. Analizzando elemento per elemento:
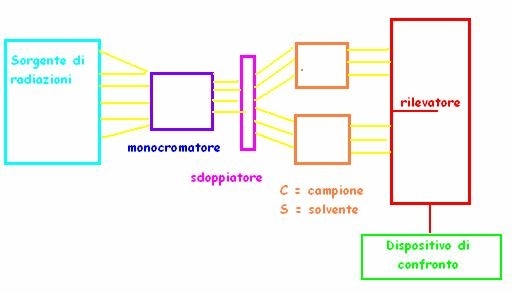
Sorgente = di solito costituita da due lampade che emettono spettri continui, una nel visibile (lampada a incandescenza) e una nell’UV (lampada ad idrogeno); è da essa partono le radiazioni.
Monocromatore = dispositivo (o a prisma o a reticolo di diffrazione) capace di selezionare con continuità solo la radiazione dell’intervallo di lunghezza d’onda che vogliamo arrivi al campione.
Sdoppiatore del raggio = sistema ottico che permette di dividere il fascio di radiazioni in 2 perfettamente identici.
Celle = i due raggi arrivano a due celle di quarzo (usato perché trasparente alle radiazioni usate) separate, una contenente il campione disciolto (C), l’altra contenente il solvente (S).
Rilevatori = fotosensibili, permettono di misurare con precisione l’intensità della radiazione che ha superato il campione e il solvente.
Dispositivo di confronto = confronta gli spettri sottraendo poi le interferenze del solvente.
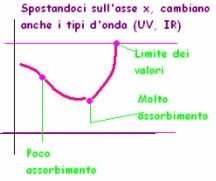
I fenomeni provocati nel campione dall’assorbimento cambiano a seconda della lunghezza d’onda della radiazione incidente, ma la quantità di radiazione assorbita in corrispondenza delle diverse lunghezze d’onda dipende dai composti presenti nel campione. L’assorbimento poi viene visualizzato tramite uno spettro, che sarà caratteristico per ogni specie chimica, grazie al confronto con spettri standard.
Ogni elemento ha uno spettro caratteristico perché assorbirà le diverse lunghezze d’onda in maniera peculiare. Sull’asse x il valore usato lo chiamiamo λ (radiazione originale) mentre su y riportiamo il valore della stessa onda in uscita.
L’unione di tutti i punti (valori misurati) forma una curva che ha picchi caratteristici per ogni elemento.
Noi misuriamo per convenzione il valore della radiazione trasmessa (che filtra) ma potremmo misurare quella assorbita; però è comunque facile ricavare l’altro valore, visto che il loro totale darà sempre la quantità di radiazione emessa dalla sorgente.
Come già detto, esistono due tipi in generale di analisi spettroscopiche:
- Tecniche molecolari: le radiazioni reagiscono con le molecole del campione.
Informazioni qualitative e quantitative sui composti molecolari
Tecniche importanti: UV-vis, IR, Raman
- Tecniche atomiche: le radiazioni reagiscono con gli atomi del campione solubilizzato.
Informazioni qualitative sugli elementi
Assorbimento ed emissione atomica
Otteniamo informazioni soprattutto riguardo i gruppi funzionali che sono tipicamente caratteristici del livello molecolare; essi sono chimicamente, dei gruppi di atomi che caratterizzano le molecole conferendogli particolari proprietà. Esistono gruppi funzionali inorganici (carbonati, nitrati, fosfati) e organici (gruppo ossidrilico, carbossilico…).
Gli elementi riconoscibili a livello molecolare sono i gruppi funzionali perché si ripetono in modo sempre uguale nella forma dei picchi e in punti precisi dello spettro, formando combinazioni uniche per ogni tipo di sostanza (calce, gesso, malte); infatti anche se cambio la radiazione iniziale λ , la forma del picco rimane sempre invariata. Perciò per riconoscere una sostanza, basta riconoscere uno o più picchi caratteristici per comprendere di che molecola ci stiamo occupando.
I picchi caratteristici si riconoscono soprattutto per 3 caratteristiche:
- La forma dei picchi (informazione sul gruppo funzionale) (rotonda/sharp).
- La lunghezza d’onda sulla quale si posizionano nel grafico (identifica il composto) (bande di riferimento: 424-873-712).
- L’intensità relativa del picco (informazioni sulla quantità del composto)
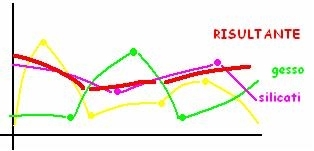
SVANTAGGI - Il problema è che tutte le molecole presenti nel campione reagiscono alle radiazioni coi loro gruppi funzionali, facendo registrare nel grafico tantissimi picchi che si confondono tutti insieme; le interferenze più frequenti sono:
- Più specie chimiche esistono nel campione, più è difficile aver chiarezza e precisione.
- Altre sostanze possono avere picchi caratteristici molto simili, come Ca e Mg.
- Sostanze presenti in scarsa quantità possono non venire rilevate, in quanto causano variazioni minime dello spettro già tracciato da sostanze più massicciamente presenti.
SOLUZIONE - Fortunatamente, quando analizziamo un campione, abbiamo già un’idea almeno vagamente di cosa troveremo nel campione, cioè quali sostanze. Da questo punto possiamo osservare se nello spettro risultante sono riconoscibili almeno in parte gli spettri caratteristici (standard) dei composti che mi aspettavo di trovare. L’interpretazione umana delle curve è sempre migliore di quella effettuata automaticamente dalle macchine, in quanto tiene conto della non-coincidenza perfetta, parte dovuta a alterità chimiche del tipo di composto, parte dovute alle interferenze più o meno massive di altre sostanze (che l’umano può considerare).
Permette l'identificazione di gruppi funzionali che caratterizzano sia composti organici che inorganici presenti nello strato pittorico.
Viene usata molto ma come tecnica preliminare, dato che praticamente tutte le sostanze reagiscono ai raggi infrarossi, diversamente dalle lunghezze d’onda degli ultravioletti o dello spettro visibile. Lo usiamo quando e se non sappiamo quasi nulla del nostro campione, perché rileva sia sostanze organiche che inorganiche.
SPETTRO INCIDENTE- Di tutto il vasto spettro degli infrarossi, scegliamo col monocromatore solo l’intervallo interessante per i beni culturali, ovvero quello tra 700- 4000 nm.
TRASFORMATA DI FOURIER
- E’ un metodo che elabora il segnale tramite una complessa procedura matematica permettendo una sensibilità dello strumento molto maggiore; in questo modo riesce a captare anche segnali molto deboli. Per questo ormai sempre quando si parla di spettroscopia IR si dice Ft-IR.Teniamo conto che ancora, il rapporto tra assorbanza e trasmittanza è: A= -log T
METODO DI ACQUISIZIONE- Ovvero come il campione viene indagato.
- TRASMISSIONE- pastiglie di KBr o NaCl e celle di diamante
- RIFLESSIONE – sezioni lucidi trasversali
- RIFLETTANZA TOTALE ATTENUATA (ATR) – campione così com’è (si esegue solo analisi di superficie)
PASTIGLIE E CELLE DI DIAMANTE, LE PIU’ USATE- In generale i porta-campioni sono molto diversi a seconda dello stato di aggregazione della materia. Vediamo i due metodi più usati:
PASTIGLIE = Nel caso del NaCl viene presa 1 pp di campione e 5 pp di sale e vengono pastigliate insieme da una macchina detta appunto pastigliatrice. Otteniamo così delle pastiglie trasparenti di 2-3 cm di diametro x 0,5 cm di spessore in cui il campione è immerso come in una matrice: i Sali scelti sono trasparenti al medio IR così che non danno nessuna interferenza. Così si eliminano le interferenze. Se ad esempio facessimo una pastiglia di solo campione, la trasmittanza sarebbe troppo bassa per avere dati accettabilmente precisi: diluendo il campione in una matrice invece, arriva più segnale perché c’è meno assorbanza.
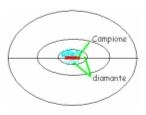
CELLA DI DIAMANTE - Sono 2 calotte semi-sferiche di materiale trasparente di diametro 3-4cm. Al centro ci sono due facce piane di 0,5-1 cm e dentro ancora, ci sono due faccine ancora più piccole di diamante; con un microbisturi posizioniamo pochissimi granelli di campione tra le due facce. Chiudendo la cella, il campione viene macinato tra le due facce. Lo scrigno chiuso viene poi analizzato.
In questo modo c’è ancora meno concentrazione di campione, così che il segnale è ancora più forte vista la debole assorbanza del campione.
Si usano piccolissime quantità di campione; le pastiglie contengono circa 10-20mg di campione, mentre le celle possono utilizzare pochissimi granelli di un solo strato.
COMPOSTI INDAGABILI - Riusciamo a indagare moltissimi tipi di composti, anche i liquidi (leganti organici, lipidi e resine) che anche se sono meglio indagabili con altre tecniche (spettrometria di massa), è utile esaminarle con la spettroscopia Ft-IR perché ci permette di identificarli almeno genericamente (anche perché la spettroscopia è molto costosa e non sempre possibile quindi). Perciò per sapere almeno le classi dei composti dei leganti organici di un’opera, facciamo un’estrazione dall’opera con solventi organici (con un cotton-fiocc imbevuto di solvente che scioglie solo il legante), perché in genere la gran parte di un’opera è inorganica e quindi insolubile ai solventi organici che scegliamo. Ovviamente scegliamo un solvente (acetone, etere, benzene) che sia di polarità molto simile a quella del legante che voglio sciogliere (simile scioglie il simile): bisogna trovare il solvente adatto; posso anche riscaldare per accelerare la reazione. Per leganti diversi, è necessario ripetere ogni volta l’operazione coi solventi giusti.
Poi bisogna separare il legante dalla matrice di solvente: in genere basta il semplice deposito del non-disciolto. Il campione poi viene impastigliato col NaCl: per eliminare altre interferenze del solvente (che può esser rimasto in tracce), lo facciamo evaporare, visto che lo fa anche a basse temperature (a volte basta una temperatura ambiente di 20-25°C).
- Purtroppo però, la spettroscopia con le pastiglie è distruttiva, perché così si separa per sempre il legante e campione, che in più viene sciolto, e quindi proprio fisicamente distrutto.
Specchietto dei composti indagabili:
- Organici: sostanze proteiche, oli, cere e resine, vernici, adesivi, leganti, molti pigmenti.
- Inorganici: carbonati, solfati, nitrati e in misura minore silicati. Sali inquinanti, materiali usati in restauro.
TEMPI - Tecnica abbastanza veloce (un'oretta) è utile se il restauratore ha bisogno di sapere subito quale è il legante. Per questo la spettroscopia si presta molto bene a molte analisi, pure organiche.
IDENTIFICAZIONE- Ovviamente si identifica il composto tramite il confronto con spettri standard, desunti o da atlanti specializzati o da banche dati digitali, facendo un confronto rispettivamente a occhio (consideri le caratteristiche dei picchi) o automatico (il computer confronta automaticamente i picchi).
Nella storia dell’arte ci sono molti testi, anche antichi, che parlano della composizione e della preparazione dei leganti organici e dei pigmenti nelle diverse epoche. Questi dati sono molto utili, ma non tengono conto che nel corso del tempo, questi composti possono subire alterazioni chimiche, anche molto importanti. Bisogna tenere conto di questo costruendo delle banche dati. E’ per questo motivo infatti, che stanno fiorendo gli esperimenti con campioni invecchiati artificialmente: i campioni vengono posti in camere con atmosfera controllata, dove vengono sottoposti a continui cicli di variazione di temperatura e umidità, vengono sottoposti a raggi UV, per aumentare l’invecchiamento. Simulando quello che nella realtà fa l’esposizione continua all’aria, quindi alle stagioni e agli agenti atmosferici. Di solito i provini sono parallelepipedi standard o vetrini con molti tipi di materiale lapideo, anche spalmati di leganti inorganici o altro (come metalli pesanti, cioè di di transizione, che sono molto catalizzatori nelle reazioni di degrado.
Precisiamo comunque che chi fa questi esperimenti sa perfettamente che le camere di invecchiamento non possono rendere le reali condizioni di invecchiamento naturale di un opera; per questo ci sono anche esperimenti di invecchiamento naturale, ma che ovviamente potranno dare risultati utili solo nel giro di molti secoli a venire.
TECNICA PRELIMINARE E ACCOPPIATA - L’approccio in chimica analitica è sempre multi-tecnico, anche perché così i diversi risultati si confermano a vicenda. Si usano sempre almeno due tecniche, anche se a volte riferendomi agli standard e a quello che sappiamo dell’opera, si possono datare con certezza.
In ogni caso, è importante dire che la spettroscopia IR, come già detto, è un’importante tecnica preliminare che permette di indagare una gran quantità di composti (pur con i suoi limiti), a costi relativamente bassi, permettendo di fare uno screening generale dei composti presenti nell’opera, da indagare poi in maniera più precisa con altre tecniche.
PRO E CONTRO - come già accennato:
- PRO: costi abbastanza bassi, sensibilità, rapidità, semplicità (poche manipolazioni del campione) e versatilità, poco campione (intorno a 1mg).
- CONTRO: poca selettività, interferenze (di conseguenza!), poca sensibilità per alcune classi di composti, analisi semi-quantitativa.
ANALISI SEMI-QUANTITATIVE - Sono effettuabili confrontando l’assorbimento di una sostanza registrato ad una lunghezza d’onda, con una curva di taratura “assorbimento-concentrazione” pre-determinata per la stessa sostanza. Il grado di precisione però è molto approssimativo.
Ovvero la spettroscopia Ft-IR accoppiata col microscopio. Può analizzare pochissimi μm (5-10μm di irraggiamento) di campione selezionati col microscopio.
VANTAGGI: analisi non distruttiva dei campioni, analisi molto ordinate e selettive, analisi di stratigrafie (cross-section) in successione veloce ma soprattutto separatamente.
SVANTAGGI: molto costosa, interferenze.
Riguardo quest’ultimo problema delle interferenze, ovviamente analizzando composti molto complessi, c’è una importante sovrapposizione di bande e di conseguenza difficoltà a interpretare gli spettri. Perciò vengono fatte delle estrazioni per limitare la varietà di composti con:
- Celle di diamante: prelevi pochissimi granelli
- Estrazione con solvente: usiamo per i composti organici acetone e etere, mentre per i composti inorganici l’acqua (nitrati, solfati…) (ma anche per alcuni organici, come la gomma arabica).
PROBLEMA DELL’AREA PICCOLISSIMA SELEZIONABILE - Possiamo certamente fare indagini precisissime (come strato per strato senza errori) ma più piccola è l’area d’indagine, più difficile è la ricerca.
Importante perché NON E’ DISTRUTTIVA, perché basta passarle al microscopio.
Esempi:
- Stele di Rosetta: aveva un aspetto lucido che si è perso perché la cera si è mischiata con le polveri (si è scoperto con quest’analisi).
- Bande delle resine: alcune hanno spettri molto simili, a causa di gruppi funzionali uguali.
- Bande pigmenti moderni: molti sono sintetici ed è più complicato perché hanno bande molto dense.
- Esperimenti di invecchiamento artificiale: fino ai 200 anni fa, ora possiamo dare datazioni sicure.
Lunghezze d’onda di bande d’assorbimento: dipendono da legami presenti nella molecola caratteristiche di ogni sostanza o gruppo di sostanze simili: ogni spettro di assorbimento IR fornisce informazioni su gruppi funzionali.
Campione: puo essere analizzato tal quale in cella di diamante o tramite microscopio interfacciato con lo strumento.
Alternativa: pochi microgrammi di campione vengono inglobati in micro pasticca di bromuro di potassio (KBr).
Sulla base delle bande vibrazionali caratteristiche dei vari gruppi funzionali si puo individuare la presenza dei materiali costitutivi il dipinto.
FT-IR: permette di identificare ossalati, materiali di sintesi, oli, cere, resine naturali, grassi, proteine e altre sostanze organiche.
Difficilmente permette distinguere tra vari materiali appartenenti alla stessa classe.
Fornisce informazioni di base relative a classe dei composti organici presenti e aiuta nella scelta delle successive indagini.
FT-IR IN RIFLESSIONE SPECULARE: permette ottenere mappe degli strati del dipinto in sezione e in funzione dello specifico assorbimento.
Il nome deriva dal fisico indiano che ha studiato questo fenomeno.
Questo tipo di spettroscopia si basa sull’analisi delle radiazioni che escono dal campione con un’angolatura di 90° rispetto alla radiazione incidente: è un segnale meno intenso, ma che dà informazioni importanti.
Per questo motivo la sorgente è molto potente, intorno ai 500-700μm; per questo fino agli anni ’70 era un’analisi pericolosa perché si utilizzavano raggi del visibile, mentre ora col laser il segnale è più forte di per sé, quindi non ci vuole un’intensità di raggi come prima.
La diffusione delle diverse lunghezze d’onda viene sempre calcolata come spettri d’intensità / λ (radiazione incidente).
- Permette di analizzare composti sia organici che inorganici.
- Tecnica non distruttiva
- Permette analisi in situ (è anche portatile): addirittura, i materiali scrittori (manoscritti e pergamene) sono indagabili direttamente (più è pregiato un’opera, meno è campionabile).
- Campo d’indagine più ristretto dell’FTIR.
- Bisogna usare campioni in sezioni lucide; il Raman è trasparente all'acqua (mentre l’IR l’assorbe, facendo bande fastidiose)
- Pigmenti minerali e organici in dipinti murali, miniature, pergamene, ceramiche, vetri
- Inchiostri
- Vetri
- Fibre tessili
- Prodotti da alterazione (pellicole o ossalato, biocolonizzazioni).
Come per l’FTIR, è una spettroscopia Raman accoppiata con un microscopio: vale perciò lo stesso principio operativo, con gli stessi vantaggi e svantaggi:
- Vantaggi: analisi non distruttiva, analisi di stratigrafie
- Svantaggi: apparecchio costoso
Quando una molecola è irradiata con luce di una sola frequenza, oltre ai normali fenomeni (riflessione, trasmissione e assorbimento) si producono anche due effetti di diffusione della radiazione da parte delle molecole:
1) natura elastica non comporta scambio di energia fra molecole e fotoni incidenti;
2) anelastico
EFFETTO RAMAN: comporta scambio energia livelli energetici vibrazionali della molecola risultano eccitati.
Alcuni fotoni perdono energia e sono dislocati a frequenze piu basse mentre per altri questo spostamento avvieneverso frequenze piu alte.
Spostamento di frequenza: dipende da energia del particolare livello energetico interessato indipendente da frequenza irradiante; la
MAGGIOR PARTE DI MOLECOLE HA PIU’ DI UN LIVELLO VIBRAZIONALE RAMAN ATTIVO: ci sarè un intervallo di frequenza nel raggio diffuso capace di formare due spettri speculari intorno a frequenza irradiante che costituiscono lo spettro Raman della molecola interessata allo scambio di energia descritto.EFFETTO RAMAN: NELLA MAGGIOR PARTE CASI E' TALMENTE DEBOLE DA RICHIEDERE SORGENTI MOLTO INTENSE PER RACCOGLIERE SEGNALI SIGNIFICATIVI. O
ggi è ottenuto con sorgenti laser.La spettroscopia Raman è molto efficace per individuare pigmenti in modo non distruttivo. Elevata è la risoluzione spaziale utile per identificare pigmenti misti.
Tecnica complementare a IR: misura la luce diffusa dai gruppi funzionali dopo l'irraggiamento con radiazione generata da laser e focalizzata da microscopio direttamente su uno spot superficiale molto piccolo.
Aspetti negativi
: presenza di fluorescenza generata quando si eccita un campione nelle vicinanze di una sua banda elettronica di assorbimento in generale molto più intensa del segnale Raman: in alcuni casi impedisce l'osservazione dello spettro.
E’ pochissimo usata e l’accenniamo solamente perché è molto specifica e quantitativa.
L’intervallo di radiazione incidente (= scelta col monocromatore), comprende UV lontano (10-200 nm), l’UV vicino (200-380) e il visibile (380-780), anche se a noi interessano più gli ultimi due.
Si basa sull’assorbimento da parte del campione di radiazioni del campo dell’ultravioletto e del visibile dovuto a presenza nel campione di gruppi funzionali.
Utile come tecnica di analisi preliminare in particolare nella caratterizzazione composti coloranti.
Si possono usare quantità minime di campione, che però deve essere disciolto in soluzione ma parzialmente. Va scelto un solvente che non provochi forti interferenze. Viene mantenuto in un porta-campione apposito chiamato UVetta, che è aperto sul lato superiore e inferiore per fare filtrare la radiazione. Le altre pareti sono di quarzo, che non danno interferenze. Le altre pareti sono anche zigrinate per sapere dover toccare l’UV netta con le mani senza inquinarne la superficie.
Ci dà informazioni:
- Qualitative – ma non sono molto importanti visto il discorso già fatto della sovrapposizione (es: l’ocra gialla ha 3 picchi con bande larghe, che appunto essendo larghe si possono perdere nei picchi di altre sostanze)
- Quantitative- (più importante) grazie alla legge di Lambert Beer, possiamo ricavare delle rette di taratura.
La legge di Lambert Beer ci permette di ricavare la diminuzione di intensità dopo il passaggio attraverso il campione rispetto alla intensità della radiazione incidente. Notiamo che la assorbanza è direttamente proporzionale alla costante data dalla concentrazione dell’analita.
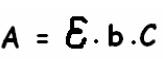
A = assorbanza (possiamo calcolare la trasmittanza con l’equivalenza A = - log T, di trasmittanza = I / I0 = radiazione trasmessa / radiazione incidente)
ε = coefficiente di estinzione molare (specifico per ogni sostanza)
b = cammino ottico (spessore del campione)
C = concentrazione
Grazie a questa legge posso anche costruire rette di taratura, con l’equivalenza analoga A = K e C, in cui l’assorbanza è direttamente proporzionale alla trasmittanza. Ovviamente però anche l’UV etta fa un minimo di interferenza, che infatti è considerata dalla costante K, che dipende dalla sostanza e dalla larghezza dell’UV netta, calcolata di solito in via empirica o usando delle rette di taratura.
Prendendo 4 soluzioni standard contenenti la stessa sostanza a concentrazione nota, ma l’una il doppio dell’altra (es: M1 = 0,1 conc, M2 = 0,2 conc). Se le misuro dovrei ottenere diretta proporzionalità tra assorbanza e riflettanza (sommandole otterrei la quantità iniziale), invece parte della radiazione si disperde a causa della seppur minima interferenza del campione. Mettendo insieme i dati ottenuti costruisco la retta di taratura che dovrebbe eliminare ogni influenza esterna nei risultati finali.
Spesso le rette di taratura si calcolano a mano perché tutte le misure analitiche sono suscettibili d’errore (per lo strumento, per la preparazione e per errori sperimentali).
LIBRO - E= log . I0/I = ε . d . c
E= estinzione,
I0 = intensità radiazione incidente,
I= radiazione trasmessa,
d= spessore della cella che contiene il campione,
ε= coefficiente di estinzione.
Nel complesso, la legge di Lambert Beer permette di correlare un dato spettrofotometrico sperimentale con la concentrazione di un analita.
Il grande limite è dato dal fatto che per questa analisi si richiede quasi sempre la solubilizzazione della sostanza, il che è applicabile su pochi tipi di bene culturale, come:
-
Pigmenti organici, quindi utile per materiali tessili- Ioni metallici o molecolari (nitriti, nitrati e solfiti) nei materiali lapidei, prima però che si siano formati composti derivati che alterano la assorbanza del campione.
- Esistono comunque dei metodi molto più efficaci per i metalli.
- Coloranti (soprattutto di materiali tessili e lacche), anche se devono subire diversi trattamenti (e quindi servono prelievi non piccoli)
- Materiali incogniti: si possono legare alti campi di assorbimento a valori di concentramento alti.
L'analisi quantitativa si basa su proprietà del campione - esposto a radiazione di una determinata lunghezza d’onda - di assorbire energia e riemetterla sotto forma di una radiazione di lunghezza d’onda uguale o piu lunga di quella incidente.
Se avviene
remissione in periodo di circa 10-9 secondi si ha FLUORESCENZA, se avviene dopo 10-9 secondi si ha FOSFORESCENZA.L'analisi usa la luce emessa dal composto in esame per determinare la sua concentrazione. Deve essere eseguita in soluzioni molto diluite. L'apparecchio è costituito da grande lampada a raggi UV che irradia soluzione.
Osservazione: avviene in direzione perpendicolare a raggi incidenti e misura l'intensità dei raggi emergenti e viene fatta attraverso fotocellule.
Durante l'analisi si devono tenere costanti la lunghezza d’onda della luce incidente, il PH e la temperatura delle soluzioni.
Utile per identificazione e dosaggio dei vari componenti organici.
Si usano per misurare masse di ioni e relative abbondanze allo stato gassoso.
Si ha a disposizione una grande varietà di sorgenti atte a vaporizzazione e ionizzazione di molecole e atomi non gassosi.Spettrometria di massa: consente di individuare molecole gassose (ioni) in funzione della loro massa; gli ioni prodotti per collisione fra molecole di gas da analizzare ed elettroni accelerati tanto da produrre estrazione di uno o più elettroni da orbite più esterne degli atomi; ioni estratti per mezzo di elettrodo accelerante carico negativamente.
Tecnica analitica fondamentale per studio di materiali archeologici; massimo impiego per metodi di datazione.
Studio di materiali pittorici: spettrometria di massa a introduzione diretta (
DE-MS e DI-MS, DTMS) permette di analizzare campioni disperdendo pochi microgrammi di sodio in solvente volatile e depositarlo su filamento da introdurre direttamente nella sorgente ionica in funzione della velocità di crescita della temperatura del filamento; si ottiene volatilizzazione di sostanze volatili e pirolisi di sostanze polimeriche che vengono simultaneamente ionizzate.Fornisce l'impronta digitale del campione di informazioni specifiche sui principali composti organici che lo costituiscono: difficoltosa o impossibile identificazione di composti presenti in miscela a bassa concentrazione.
Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Dispense tratte da: http://doc.studenti.it/download/skip/chimica-ambiente-beni-culturali_1.html (nel 2012, ora il sito non è più esistente)
Bib-TS-086 - M. Matteini, M. Moles, la Chimica nel restauro, Nardini editore, Firenze
7 - M. Matteini, M. Moles, Scienza e restauro, Nardini editore, FirenzeBib-TS-088 - L. Appolonia, S. Volpin, Le analisi di laboratorio applicate ai beni artistici policromi, casa editrice il Prato, Padova