Portale "Ingegneria e Campanologia" - Autore - Sommario - Mappa del Sito - Home
Strutturistica Chimica
AREA I - ARTE TECNICO-SCIENTIFICA (ATS)
Cap. ATS-F02 - Chimica - Pag. ATS-F02.04
Gli argomenti trattati sono stati inseriti da Ing. Arch. Michele Cuzzoni nel 2012 - © Copyright 2007- 2025- e sono desunti dalla documentazione indicata in Bibliografia a fondo pagina
Cristallografia e Impaccamenti
Cristallografia: Scienza interdisciplinare che studia la forma, la struttura interna e le proprietà chimiche e fisiche dei cristalli (...)
Come scienza autonoma, distinta dalla mineralogia, fornisce precise informazioni strutturali sull’organizzazione degli atomi nei solidi, permettendo la nascita e lo sviluppo di un ramo della Chimica chiamato: Strutturistica Chimica.
Nel piano, gli impaccamenti di sfere esagonale e quadrato sono differenti.
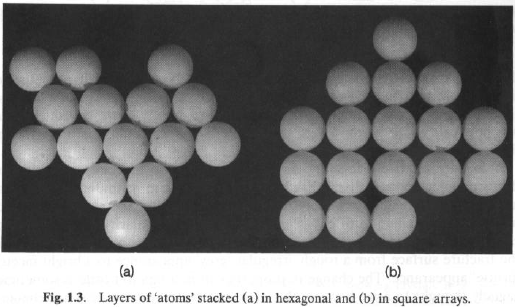
Ma i cristalli sono tridimensionali!
Come si possono costruire impaccamenti di sfere 3D a partire da strati 2D?
· Sequenza di strati esagonali compatti, impilati direttamente uno sopra l’altro (sequenza …AAAA…).
· La distanza tra piani adiacenti è dM-M. i piani sono eclissati. Non esistono elementi (composti di atomi ‘sferici’) che danno questo motivo.
· Sono troppo grossi gli spazi vuoti lasciati. Ci sono grossi canali paralleli alla direzione di impilamento.
· Se gli strati scivolano di lato, tendono ad avvicinarsi, e le concavità del primo sono occupate dalle convessità dell’altro.
· Due strati, visti dall’alto, non coincidono in prospettiva. Sono uguali ma leggermente traslati (sfalsati).
· La sequenza è AB. Ci sono canali paralleli alla direzione di impilamento.
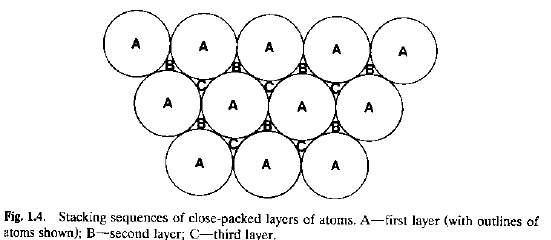
E se aggiungiamo un terzo strato?
I Caso. Se, in proiezione, coincide con A, si può estendere tale impilamento in sequenza …ABABAB…, detta struttura esagonale compatta (hcp).
· La distanza ideale tra piani adiacenti è (2/3)1/2dM-M.
· NON ci sono canali paralleli alla direzione di impilamento.
· Non ci sono catene di interstizi collegati tra di loro.
· Zn, Mg e low-T Ti hanno questa struttura cristallina.
II Caso. Se, in proiezione, il terzo strato non coincide né con A né con B, la sequenza …ABCABCABC… viene detta struttura cubica compatta (ccp).
· Anche qui, la distanza tra piani adiacenti è (2/3)1/2dM-M.
· Cu, Al, Ag, Au e high-T Fe hanno questa struttura cristallina.
Esistono anche strutture miste: (a densità costante!)
· Se periodiche, tipo …ABACABAC…, la sequenza di base è di quattro strati (elemento americio).
· Se non periodiche, sono ‘errori di sequenza’ che derivano dalle condizioni di crescita del cristallo o sue manipolazioni. Un cristallo di Co (ccp a T ambiente), può contenere ‘stacking faults’ in cui la sequenza originale …ABCABA… è sostituita da gruppi in sequenza …ABAB...
Per semplici impaccamenti compatti, è possibile evidenziare l’unità più semplice che per semplice traslazione e ripetizione, genera il cristallo intero: la cella unitaria.
La cella unitaria minimale (primitiva) potrebbe non evidenziare la simmetria totale del cristallo.
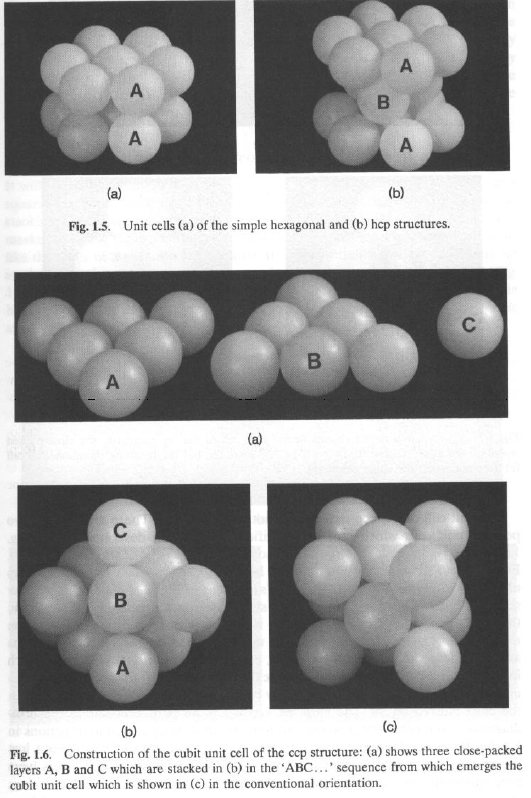

Se invece partiamo da uno strato 2D a disposizione quadrata, è possibile costruire la sequenza …AAAA… (cubica semplice, tipica dell’a-Po), rara. I piani sono eclissati. La distanza ideale tra piani adiacenti è dM-M.
Più comune è la sequenza …ABAB… con gli strati sfalsati.
Struttura cubica a corpo centrato (bcc). Gli atomi in un piano non sono più a contatto, mentre lo sono quelli tra due piani adiacenti, lungo le diagonali di corpo della cella unitaria cubica. Non è un impaccamento compatto (ad alta densità). Esempi: Cr, Mo, high-T Ti e low-T Fe.
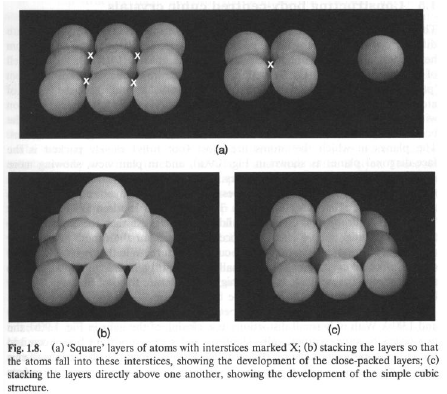
Con piccoli spostamenti è possibile trasformare una struttura bcc in una fcc, riassestando atomi nei piani diagonali. Gli interstizi hanno forma a sella e possono favorire lievi distorsioni dalla simmetria cubica. Alcune trasformazioni bcc - ccp possono essere reversibili.
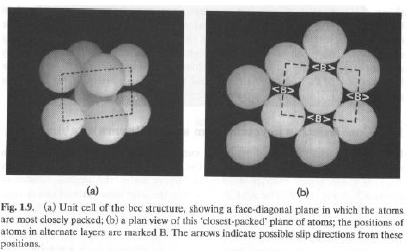
P.es. raffreddando di colpo high-T Fe (ccp, stabile a T>910°C), si ottiene la forma bcc, con relazioni geometriche, rispetto al cristallo originale, ben definite.
E per sfere di dimensioni differenti? Ovvero composti ionici basati su ioni monoatomici, non solo elementi.
Per composti binari del tipo XmAn, si individuano spesso anioni A (grossi) e cationi X (piccoli).
La maggior parte delle strutture ioniche di questo tipo sono derivate da impaccamenti semplici, di solito compatti, di anioni a contatto e cationi in cavità o interstizi.
Quindi saranno caratterizzanti:
· il tipo di impaccamento di base (hcp, ccp, bcc, cubico od esagonale semplice),
· il tipo e numero di interstizi occupati
· la regolarità di occupazione.
Rapporto dei raggi: rX/rA = r
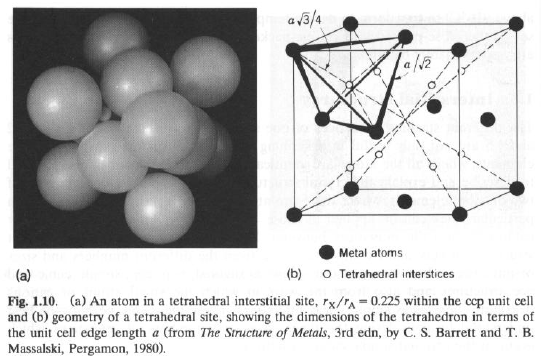
Struttura ccp: Cavità tetraedrica: r = Ö(3/2) – 1 = 0.225
Ci sono 2 cavità tetraedriche (X) per ogni atomo A.
Riempimento completo: X2A (Li2O; r = 0.42; Li2S; r = 0.29)
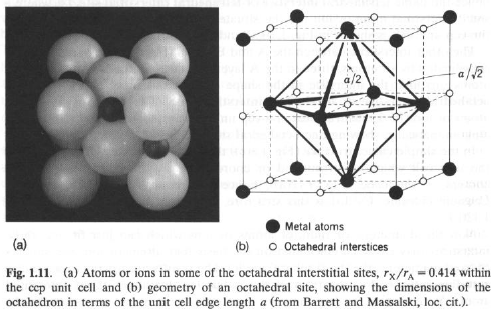
Struttura ccp: Cavità ottaedrica: r = Ö2 – 1 = 0.414
C’è una sola cavità ottaedrica (X) per ogni atomo A.
Riempimento completo: XA (LiCl; r = 0.43; NaCl; r = 0.54)
Struttura hcp: come per ccp, ma con sequenza diversa.
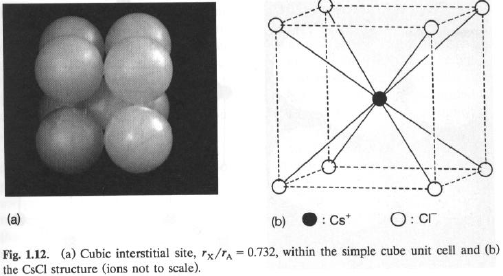
Struttura cubica semplice: Cavità cubica: r = Ö3 – 1 = 0.732.
C’è una sola cavità cubica (X) per ogni atomo A.
Riempimento completo: XA (CsCl; : r = 0.75)
Struttura cubica centrata: Cavità ottaedrica distorta: r = 0.154.
Struttura cubica centrata: Cavità tetraedrica distorta: r = 0.291

Idruri, Boruri, Carburi e Nitruri Metallici interstiziali, ma Stechiometrici:
Gli atomi interstiziali sono leggermente più grandi delle cavità allocate, per cui espandono il reticolo ideale dei metalli di base.
Cella a0 (Å): Ti: 4.132; TiH: non noto; TiH1.5: 4.402; TiH2: 4.452.
Per il metallo Titanio (ccp - fcc):
N in tutte le cavità ottaedriche: TiN (NaCl) rN/rTi » 0.50
H in tutte le cavità tetraedriche TiH2 (CaF2) rH/rTi » 0.26
H in metà le cavità tetraedriche TiH (ZnS blenda) rH/rTi »0.26
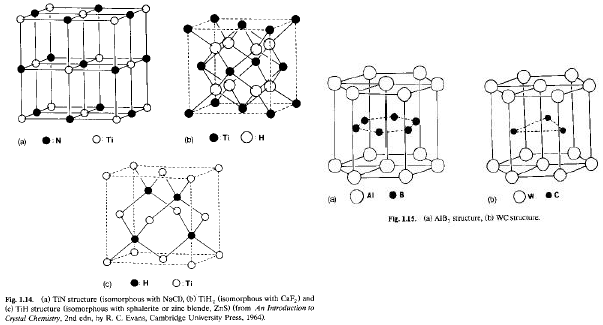
Anche se non ci sono metalli che cristallizzano in impaccamenti esagonali semplici, ne esistono alcuni derivati interstiziali:
· AlB2 Impaccamento Esagonale semplice di Al + cavità a prisma trigonale (1:2) di B
· WC Impaccamento Esagonale semplice di W + metà delle cavità a prisma trigonale di C Correlazione composti interstiziali – composti ionici: Composti interstiziali: idruri, carburi, boruri, nitruri.
· Per lo più ‘covalenti’;
· Sono impaccati in modo compatto i metalli (grossi);
· H, B, C ed N (più piccoli) sono interstiziali.
Composti ionici: ossidi, alogenuri, solfuri.
· Per lo più ionici (ma non solo!);
· Sono impaccati in modo compatto gli anioni (grossi);
· I metalli (più piccoli) sono interstiziali.
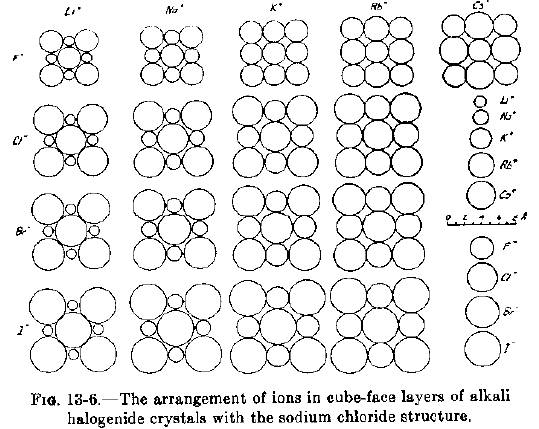
Da L.Pauling, The Nature of the Chemical Bond, Cornell University Press, Ithaca, NY, 1960
Esempi:

Portale "Ingegneria e
Campanologia" -
Autore -
Sommario
- Mappa del Sito -
Home
Bib-TS-081 - Prof. N. Masciocchi - Dispense del Corso di Laurea in Chimica - Insegnamento di strutturistica chimica
Bib-TS-082 - C.Hammond - The Basics of Crystallography and Diffraction - Ed. International Union of Crystallography and Oxford University Press, 240 pg. (Ed. italiana: Zanichelli)
Bib-TS-083 - J.P.Glusker & K.N.Trueblood - Crystal Structure Analysis: A Primer - Oxford University Press, 220 pg. (non tradotto).